Химия высоких энергий, 2021, T. 55, № 5, стр. 347-355
Спектрально-люминесцентные свойства бисазометина на основе 2-гидрокси-1-нафтальдегида и 2,3-диаминопиридина
И. Р. Мардалейшвили a, *, Л. С. Кольцова a, Н. Л. Зайченко a, О. Н. Крутиус a, А. И. Шиенок a
a Федеральное государственное бюджетное учреждение науки Федеральный исследовательский центр химической физики им. Н.Н. Семенова Российской академии наук
119991 Москва, ул. Косыгина, 4, Россия
* E-mail: marli2007@yandex.ru
Поступила в редакцию 26.04.2021
После доработки 11.05.2021
Принята к публикации 11.05.2021
Аннотация
Исследованы спектрально-люминесцентные свойства растворов бис гидроксинафтоазометина пиридинового ряда в сравнении с аналогом бензольного ряда. Наличие атома азота пиридина в орто- положении к азометиновой группе способствует образованию кето-формы азометинового фрагмента в основном состоянии молекулы. Положение максимумов люминесценции растворов слабо зависит от присутствия в гетероцикле атома азота, а в большей мере определяется полярностью растворителя. В полярных средах наблюдается более длинноволновая и более эффективная люминесценция.
Азометины – хорошо известный класс соединений, представляющий интерес благодаря многообразию их химических, физических и биологических свойств. Производные салицилиденанилина давно исследуются благодаря их фото- и термохромным свойствам. Азометины 2-гидрокси-1-нафтальдегида исследовались менее широко, чем производные салицилиденанилинов [1–4], так как в растворах и в порошках уже присутствует смесь енольной и кето-формы [5, 6], что снижает интерес к этим соединениям как к фотохромной системе. Однако азометины нафталинового ряда менее чувствительны к структурным изменениям и более устойчивы к УФ облучению [4], а в растворах люминесцируют эффективнее салицилиденовых производных, квантовый выход люминесценции которых в растворах крайне низкий [7]. Люминесцентные свойства некоторых нафтопроизводных с бензольной аминной составляющей исследовались в аналитических целях для определения ионов металлов [8, 9]. Исследовали люминесцентные свойства комплексов нафтоазометинов c бензольной аминной частью с Аl, Cu, Mn, Ni, Zn [8–11], лантаноидами [12], аминокислотами [13], их каталитичеcкую активность [14] и стабильность.
В последние годы исследовали производные бензоазометинов [15–19] и меньшей мере нафтоазометинов [19–22] с пиридиновой аминной частью. Отмечены антибактериальные свойства нафтоазометинов с пиридиновой аминной частью и их комплексов с металлами [21] и их высокая гидролитическая стабильность.
Исследования люминесцентных свойств азометинов на основе о-гидроксиароматических альдегидов и аминопиридинов немногочислены и касаются салицилиденовых азометинов [18], в то же время исследования люминесценции нафтоазометинов в литературе отсутствуют.
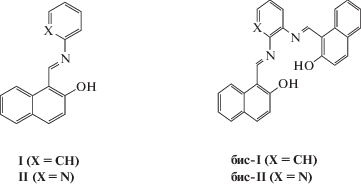
В настоящей работе исследовали спектрально-люминесцентные свойства растворов бис-азометина 2-гидрокси-1-нафтальдегида и 2,3-диаминопиридина. Для выявления влияния атома азота гетероцикла на спектры поглощения и люминесценции пиридинового бисазометина (бис-II) привлекались спектрально-люминесцентные данные для моноазометина пиридинового ряда (II), а также производных бензольного ряда – (I) и (бис-I).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исследуемые моно- и бис-соединения синтезированы по известным методикам [8, 21, 22]. Для приготовления растворов использовали растворители фирмы Acros без дополнительной очистки. Спектры поглощения растворов (c = 2 × 10–4–2 × 10–6 M) регистрировали на спектрофотометре MultiSpec1501, спектры люминесценции (c = 10–5–2 × 10–6 M) на спектрофлуориметре Perkin Elmer LS 55. Квантовые выходы люминесценции растворов при возбуждении 420 нм и оптических плотностях 0.1 оценены с использованием в качестве стандарта раствора рубрена в гептане с известным квантовым выходом люминесценции φ = 1.0 [24]. Спектры ЯМР 1Н регистрировали на приборе Brucker Avance, 500 МГц в растворах ДМСО-d6 и CDCl3.
РЕЗУЛЬТАТЫ
Спектры поглощения мононафтоазометинов I, II
Все исследуемые соединения являются производными хорошо известного соединения I [5, 6], структура которого усложнена заменой бензольного кольца аминной части на пиридин и (или) введением в аминную часть второй азометиновой группировки.
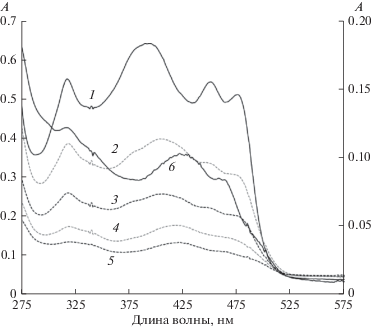
В растворах мононафтоазометина бензольного ряда соединения I характерно наличие двух таутомерных форм – енольной (Е) и кетонной (К), соотношение между которыми зависит от растворителя, что проявляется в спектрах поглощения (рис. 1). В растворе I в толуоле наблюдаются основная полоса с максимумом 370–375 нм, относящаяся к Е-форме, и длинноволновые полосы с максимумами 440 и 462 нм от К-формы. В метаноле преобладает К‑форма со значениями максимумов полос поглощения 439 и 458 нм. Наличие двух длинноволновых полос поглощения объясняли наличием по крайней мере двух изомеров К-формы [5].
Рис. 1.
Спектры поглощения соединений I (1, 2) и (II) (3, 4) в толуоле (1, 3) и этаноле (2, 4), с = 10–4 М.
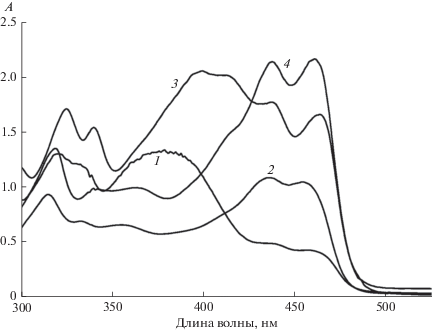
В растворах нафтоазометина пиридинового ряда II, также, как и в растворах нафтоазометина бензольного ряда I, наблюдается зависимость спектра поглощения от растворителя, в основном связанная с влиянием на кето-енольное равновесие. В толуоле присутствуют обе изомерные формы, при этом соотношение изомеров в большей степени сдвинуто в сторону К-формы, чем в растворе I (рис. 1). При переходе к полярной спиртовой среде наблюдается усиление вклада длинноволновых полос, обусловленное преобладанием К-формы.
Замена бензольного цикла на пиридиновый с орто-положением амино-группы по отношению к атому азота гетероцикла способствует смещению равновесия в сторону К-формы в мононафтоазометине II. Подобное влияние атома азота гетероцикла отмечали авторы работы [20] базируясь на сравнительном анализе данных ЯMP в ДМСO для замещенных бензо- и орто-пиридин производных моно-нафтоазометинов.
Присутствие атома N пиридина в моно-соединении II в орто-положении приводит к росту поглощения и заметному батохромному сдвигу (409 нм) полосы поглощения в УФ-области спектра по сравнению с I. При этом положение полос в видимой области спектра, обусловленное наличием К-формы, практически не меняется (рис. 1, табл. 1). Рост поглощения обеих таутомерных форм II в сравнении с I и слабая зависимость положения максимумов спектра поглощения К-формы наблюдались для растворов II и в других растворителях [22].
Таблица 1.
Максимумы полос спектров поглощения и флуоресценции исследуемых соединений в различных растворителях
| Соединение | Растворитель | λмакс (нм) | λem (нм) |
|---|---|---|---|
| I | Толуол Этанол |
323, 334, 379, 440, 462 318, 335, 358, 439, 458 |
497, пл. 526 500, пл. 527 |
| II | Толуол Этанол |
326, 341, 402, 415, 440, 465 321, 342, 366, 415, 439, 463 |
490–510 485–490 |
| бис-I | Кр.порошок | 483, 525 | 545–557 |
| Толуол | 327, 375, пл. 453, пл. 477 | 508, 526 | |
| МХ | 323, 374, 454, 479 | 517, 535 | |
| Ацетонитрил | 321, 370, 449, 475 | 510, 527, 546 | |
| Этанол | 321, 373, 392, 455, 478 | 511, 535 | |
| ДМФА | 324, 374, 455, 477 (с = 10–4 М) | ||
| 326, 415, 474 (с < 10–5 M) | 519, 551 | ||
| бис-II | Кр.порошок | 483, 525 | 569–572 |
| Толуол | 326, 385, 452, 479 | 504, 525 | |
| МХ | 317, 370–400, 446, 472 | 503, 527 | |
| Ацетонитрил | 321, 379, 449, 475 | 520, 547 | |
| Этанол | 319, 393, 452, 477 (с = 10–4 М) | ||
| 319, 426, 463 (с = 2 × 10–6 M) | 524, 553 | ||
| ДМФА | 380–400, 452, 478 (с = 10–4 М) | ||
| 338, 433, 472 (с = 2 × 10–6 M) | 527, 557 |
Спектры поглощения биснафтоазометинов бис-I, бис-II
Введение второй азометиновой группировки при переходе от мононафтоазометина I к бис-I приводит к росту поглощения в толуоле и небольшому смещению длинноволновой границы спектра поглощения в красную область, обусловленному смещением полос от К-формы (рис. 2, табл. 1). Положение максимума полосы от Е-формы (374 нм) близко в наблюдаемому в растворе I. Как и в растворе I в спектре поглощения бис-I в толуоле преобладает поглощение Е-формы. В метиленхлориде и этаноле наблюдается увеличение содержания К-формы бис-I, при этом поглощение от Е-формы остается преобладающим. Положение максимумов полос от К-формы слабо зависит от полярности среды.
Рис. 2
. Спектры поглощения I (1), II (2), бис-II (4) в толуоле, бис-I (3) в толуоле, МХ (5) и этаноле (6), с = 10–4 M.
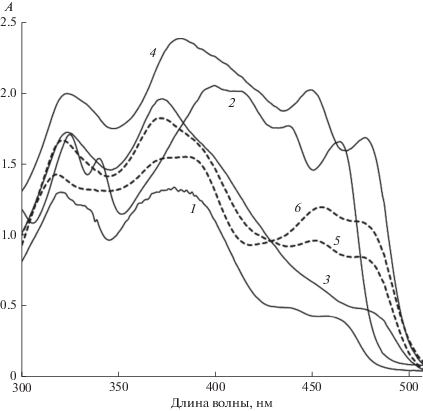
Наличие второй азометиновой группировки в бис-соединении пиридинового ряда бис-II приводит к небольшому батохромному сдвигу длинноволновых полос поглощения от К-формы (452 и 479 нм) относительно моносоединения II (рис. 2), при этом положение полосы, относимой к Е-форме (385 нм) близко к положению, характерному для соединений бензольного ряда I и бис-I. Таким образом, в присутствии второй группировки в бис-II нивелируется эффект батохромного смещения этой полосы, наблюдаемый при замене бензольного кольца в I на пиридиновое с орто-позицией атома азота в II.
Присутствие пиридинового атома N в бис-II увеличивает относительное содержание К-таутомера в растворе толуола по сравнению с бис-I (рис. 2) аналогично наблюдаемому для монопроизводных нафтоазометинов I и II (рис. 1).
В отличие от бис-I, в растворах которого при переходе от толуола к более полярным растворителям наблюдается рост поглощения от К-формы, в растворах бис-II при переходе от толуола к МХ, этанолу (рис. 2, 3) в спектрах поглощения нет существенных изменений таутомерного равновесия. Это можно объяснить предпочтительностью процесса переноса протона только в одной азометиновой группировке и практически полным переходом этого фрагмента в К-изомер уже в слабо полярном толуоле.
Рис. 3.
Спектры поглощения бис-II в этаноле, с = 5.8 × 10–5 М (1), разбавление в 2, 3, 6, 12 и 24 раза (2–6). Кривая 6 (с = 2.4 × 10–6 М) приведена по дополнительной оси.
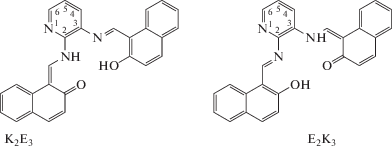
В спектрах ЯМР 1Н в полярном ДМСО–d6 наблюдаются два разных сигнала – синглет от протона азометиновой группы –СН=N– при 9.62 м.д. и дублет от аминной группы –СН–NН– при 10.01 м.д., при этом анализ соотношения наблюдаемых полос указывает на существование в этом растворе молекул только одного типа. Из этих данных ЯМР следует, что в соединении бис-II в ДМСО один азометиновый фрагмент находится в Е-, а другой – в К-форме (E2K3 или К2Е3). В слабополярном хлороформе соединение бис-II на 90–95% присутствует в форме E2K3 или К2Е3.
В соединении бис-I азометиновые фрагменты некомпланарны и в структурном плане могут быть неравноценны в отношении процесса переноса протона в основном состоянии [23]. Замена бензольного кольца аминной части на пиридин в бис-II добавляет неравноценность в отношении распределения электронной плотности в азометиновых фрагментах. Базируясь на эффекте смещения таутомерного равновесия в сторону кето-формы в соединении II можно предположить преимущественную стабилизацию К-формы в о-рто-группировке по отношению к азоту пиридина, в то время как мета-азометиновая группировка находится в Е-форме.
Положение максимумов полос поглощения и значения коэффициентов экстинкции биспроизводных бис-I и бис-II в растворах слабополярных растворителей – толуоле, метиленхлориде сохраняется во всем диапазоне исследуемых концентраций 5 × 10–6–2 × 10–4 М.
В то время как толуол являясь наиболее “пассивным” растворителем позволяет выявить структурные различия молекул бис-I и бис-II, связанные с заменой бензольного кольца на пиридин, в полярных растворителях возможны дополнительные эффекты, обусловленные взаимодействием растворителя с азометином. Так в растворах бис-I, бис-II в ДМФА при концентрациях 10–4–10–5 М наблюдается спектр поглощения, аналогичный раствору в толуоле. При хранении раствора, а также при снижении концентрации раствора наблюдается изменение спектра поглощения. С разбавлением полоса поглощения, относимая к Е-форме, смещается в красную область спектра, при этом полосы от К-формы смещаются гипсохромно.
Похожие изменения наблюдали в спектрах поглощения бис-II в этаноле (рис. 3). Спектр поглощения при концентрациях 5.8 × 10–5–1 × 10–5 М в этаноле аналогичен наблюдаемому в слабополярных растворителях (рис. 2, 3). Дальнейшее разбавление спиртового раствора сопровождается изменением спектра поглощения (рис. 3). Изменения в спектре поглощения бис-II при разбавлении спиртового раствора наблюдаются при более низких концентрациях, чем в ДМФА. Наблюдаемое изменение спектра поглощения бис-II в сильно разбавленных растворах и при хранении может свидетельствовать об эффективном взаимодействии с полярным растворителем.
Люминесценция моно- и бис-нафтоазометинов
Люминесценция моноазометина II при 20°С похожа на люминесценцию I [25, табл. 1]. Замена бензольного кольца на пиридиновое в моносоединении II практически не сказывается на положении полосы эмиссии – для обоих мононафтоазометинов в растворах характерна слабая люминесценция с максимумом около 500 нм. Переход к бис-структурам как бензольного (бис-I), так и пиридинового ряда (бис-II) сопровождается более длинноволновой люминесценцией (Табл. 1). В отличие от моносоединений I, II спектры люминесценции растворов исследованных бис-соединений бис-I, бис-II при 20°С характеризуются двумя перекрывающимися полосами в области 508–560 нм, положение максимумов этих полос зависит от природы растворителя (Табл. 1).
Две перекрывающиеся полосы люминесценция наблюдали ранее в растворах I, но только при низких температурах. Так две полосы эмиссии (480 и 510 нм) отчетливо проявляются в спектрах люминесценции растворов нафтоазометина I [6] и его производных [25 ] при 77 К. В работе [6] расщепление полосы эмиссии объясняли образованием в возбужденном состоянии двух люминесцирующих форм кето-изомера, полученного в результате переноса протона при возбуждении енольной формы и при прямом возбуждении К‑изомера.
В спектрах поглощения бис-I и бис-II присутствуют перекрывающиеся полосы поглощения от азометиновых фрагментов в енольной (Е) и в к-ето-форме (К), в зависимости от длины волны возбуждения можно ожидать преимущественного возбуждения одного из фрагментов.
В растворах, исследуемых нафтоазометинов бис-I, бис-II наблюдаются полосы люминесценции в области длиннее 500 нм (Табл. 1), а также коротковолновая люминесценция в области 430–450 нм, наиболее заметная в растворе бис-I в толуоле при возбуждении 330–370 нм.
Наблюдаемая длинноволновая люминесценция в растворах исследуемых бис-азометинов может быть обусловлена образованием люминесцирующего изомера в результате процесса переноса протона при возбуждении фрагмента с енольной формой или прямым возбуждением фрагмента в кето-форме. То есть в растворах соединения бис-II в полярных растворителях, существующем в полярных средах в виде К2Е3, длинноволновая люминесценция может исходить от возбуждения фрагмента К2 или фрагмента Е3. Коротковолновая люминесценция, по-видимому, обусловлена возбуждением енольного фрагмента в К2Е3 или в форме ЕЕ, присутствующей в небольшом количестве в растворе бис-II в толуоле и преобладающей в растворе бис-I в толуоле.
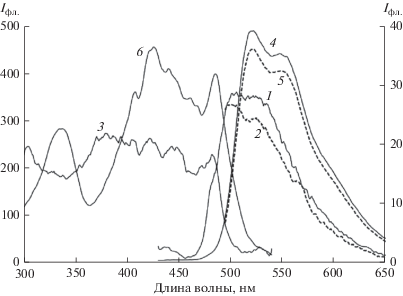
В растворах бис-II при возбуждении 420 нм наблюдается люминесценция с полосой эмиссия с максимумами 504 и 526 нм в толуоле и близкими максимумами эмиссии в метиленхлориде (табл. 1). В полярных растворителях – этаноле (рис. 4), ДМФА (рис. 5 ) характерна более длинноволновая люминесценция, причем эффективность люминесценции значительно выше, чем в толуоле (Табл. 1, 2). В полярных средах несмотря на наблюдаемые изменения спектра поглощения с разбавлением (рис. 3, Табл. 1) вид спектра люминесценции не зависит от концентрации растворов.
Рис. 4.
Спектры эмиссии люминесценции (1, 2, 4, 5) и возбуждения люминесценции (3, 6) растворов (бис-II) в толуоле (1–3, вспомогательная ось) и этаноле (4–6), Em: λвозб = 420 (1, 4) и 485 нм (2, 5), Ex: λрег = 550 нм (3, 6).
В ацетонитриле для обоих соединений бис-I и бис-II в спектре возбуждения люминесценции наблюдается дополнительная полоса с максимумом на 530 нм, и соответствующая этому возбуждению более длинноволновая полоса эмиссии 550 нм. Наблюдаемую в спектре возбуждения полосу 530 нм можно отнести к образующимся в этом растворителе структурированным образованиям. При разбавлении растворов до концентрации 10–6 М полоса 530 нм в спектре возбуждения ослабевает (рис. 6), но не исчезает, что свидетельствует об устойчивости подобных агрегатных образований в ацетонитриле.
Рис. 5.
Спектры люминесценции бис-I (1, 3) и бис-II (2, 4) в ДМФА Em: λвозб = 420 нм (1, 3), Ex: λрег = 560 нм (2, 4).
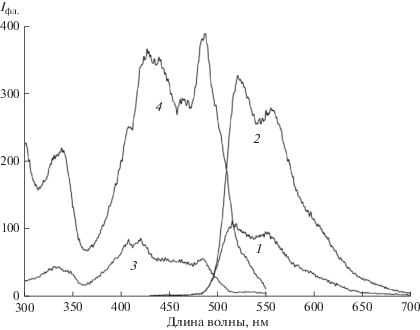
Рис. 6.
Спектры люминесценции (1–6) бис-II в ацетонитриле, с = 6.4 × 10–6 М (1–5); Em: λвозб = 330, 420, 490, 525 нм (1–4), Ex: λрег = 550 нм (5); c = 1.6 × 10–6 М (6), Ex: λрег = 550 нм (6).
Следует отметить, что полосы 490 и 530 нм являются основными в спектрах возбуждения люминесценции кристаллических порошков бис-I и бис-II. В кристаллическом порошке бис-II при любом возбуждении наблюдается одна полоса эмиссии с максимумом на 570 нм. В растворе ацетонитрила вид спектра зависит от длины волны возбуждения (рис. 6).
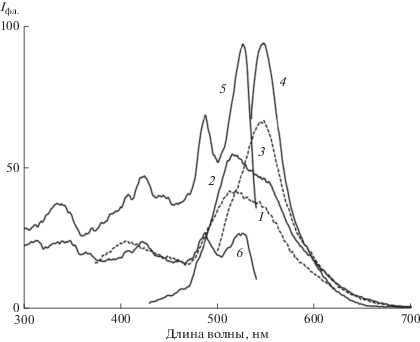
Ацетонитрил способствует образованию агрегатов бис-I и бис-II, что подтверждается ростом интенсивности полосы 530 нм в спектре возбуждения при переходе от раствора в толуоле к раствору в смеси растворителей толуола (70%) и ацетонитрила (30%) (рис. 7). Заметное проявление свойств, характерных для люминесценции бис-II в полярных растворителях наблюдается уже при 10% содержании ацетонитрила в смеси растворителей.
Рис. 7.
Спектры люминесценции бис-II в толуоле (1–4) и в смеси толуола и АСN (30%) (5–8) при c = 10–5 М и спектры поглощения в толуоле (9) и смеси растворителей (10), Em: λвозб = 420 (1, 5), 485 (2, 6) и 525 нм (3, 7), Ex: λрег = 560 нм (4, 8).
Квантовый выходы люминесценции бис-I и бис-II в толуоле низкие, слабо различаются и близки к значению для моносоединения I. В полярных средах – этаноле и ДМФА значения квантовых выходов обоих соединений (Табл. 2) значительно выше, при этом эффективность люминесценции нафтопроизводного пиридинового ряда бис-II выше, чем у нафтопроизводного бензольного ряда бис-I.
Таблица 2.
Квантовые выходы люминесценции бис-I и бис-II в растворах, λвозб = 420 нм
| Соединение | толуол | этанол | ДМФА |
|---|---|---|---|
| бис-I | 0.0014 | 0.08 | 0.12 |
| бис-II | 0.0011 | 0.13 | 0.28 |
Аналогичная тенденция к росту квантового выхода люминесценции при переходе от бензольного к пиридиновому производному наблюдалась в спиртовых растворах бис-производных на основе салицилиденанилина в работе [18].
Таким образом, для азометинов на основе нафталидена как с бензольной, так и пиридиновой аминной частью характерно наличие Е- и К-таутомерных форм даже в слабо полярных растворителях. Относительное содержание К-формы увеличивается в полярных средах. В слабополярном растворителе – толуоле для соединений пиридинового ряда наблюдается смещение таутомерного равновесия в основном состоянии в сторону К-формы по сравнению с бензольными аналогами, причем наличие атома азота пиридина в орто-положении способствует образованию К-формы как в моно-, так и в бис-производном. Замена бензольного цикла на пиридиновый в бис-соединении слабо влияет на положение максимумов полос люминесценции. В большей степени в бис-производных бис-I и бис-II проявляется зависимость люминесценции от растворителя – наблюдается батохромный сдвиг полос люминесценции и усиление эффективности люминесценции в полярных средах, причем более существенное для бис-II.
Список литературы
Rawat M.S.M., Mal S., Singh P. // Open Chemistry Journal 2015. V. 2. P. 7.
Mei J., Leung, N. L.C., Kwok R.T.K., Lam J.W.Y., Tang B.Z. // Chem. Rev. 2015. V. 115. P. 11718.
Hadjoudis E. // Mol. Eng. 1995. V. 5. P. 301.
Красовицкий Б.М., Болотин Б.М. // Органические люминофоры М. Химия 1984. С. 336.
Fabian W.M.F., Antonov L., Nedeltcheva D., Kamounah F.S., Taylor P.J. // J. Phys. Chem. 2004. V. 108. P. 7603.
Richey W.F., Becker R.S. // J. Chem. Physics. 1968. V. 49. 2092.
Vargas V. C. // J. Phys. Chem. A 2004. V. 108. P. 281.
Zhou D., Sun C., Chen C., Cui X., Li W. // J. Mol. Structure 2015. V. 1079. P. 315.
Samanta S., Nath B., Baruah J.B. // Inorgan Chem. Communication. 2012. V. 2. P. 98.
Abd-Elzaher // J. Chinese Ch. Sos. 2001. V. 48. P.153.
Abd-Elzaher // Synth. React.Inorg.Met.-Org.Chem 2000. V. 30. № 9. P.1805.
Taha Z.A., Ajloun, A.M., Momani W.A., Al-Ghzawi A.A. // Spectrochem. Acta Part A 2011. V. 81. P. 570.
Shang X., Li C., Li J., Chen Y., Chen H., Wang T. // Heterpaton Chemistry. 2018. V. 29. P. 21489.
Sarkar N., Bhaumik P.K., Chattopadhyay S. // Polyhedron. 2016. V. 115. P. 37.
Sliwa M., Mouton N., Ruckebusch C., Aloise S., Poisat O., Buntinx G., Metivier R., Nakatani K.,Masuhara H., Asahi T. // J. Phys. Chem. C 2009. V. 113. P. 11959.
Asadi M., Asadi Z., Torabi S., Lotfi N. // Spectrochimica Acta Part, A 2012. V. 94. P.72.
Dueke-Eze C.U., Fasina T.M., Idika N. // Afr. J. Pure App. Chem. 2011. V. 5. P. 13.
Barboza C.A., Germino J.C., Santana A.M., Quites F.J., Vazguez P.A.M., Atvars T.D.Z. // J. Phys. Chem. C. 2015. V. 119. P. 6152.
Jeewoth T., Kam Wah H.L., Browon M.G., Ghoorohoo D., Babooran K. // Synth. React. Inorg. Met.-Org. Chem. 2000. V. 30. Is. 6. P.1023.
Venkatachalam T.K., Pierens G.K., Campitelli M.R., Reutens D.C. // Magn. Reson. Chem. 2010. V. 48. P. 585
Abdel- Rahman L.H., Ismail N.M., Ismael M., Abu- Dief A.V.E., Ahmed A.H. // J. Mol. Struct. 2017. V. 1134. P. 851.
Nazir H., Yildiz M., Yilmaz H., Tahir M.N., Ulku D. // J. Mol. Struct. 2000. V. 534. Is. 1–3. P. 24.
Popovic Z., Roje V., Pavlovic G., Matkovic-Calogovic D., Giester P. // J. Mol. Struct. 2001. V. 597. P. 39.
Паркер С. Фотолюминесценция растворов / Под ред. Р.Ф. М. Мир. 1972. С. 253.
Мардалейшвили И.Р., Кольцова Л.С., Зайченко Н.Л., Шиенок А.И., Левин П.П., Татиколов А.С. // Химия высоких энергий. 2011. Т. 45. № 6. С. 548.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий