Химия высоких энергий, 2023, T. 57, № 1, стр. 9-13
Влияние лазерного облучения на механизм вязкого течения водного раствора хлорида натрия
Л. С. Шибряева a, *, Н. Н. Комова b, **, И. Ю. Куликова b
a Институт биохимической физики им. Н.М. Эмануэля РАН
117997 Москва, улица Косыгина, 4, Россия
b МИРЭА – Российский технологический университет
119454 Москва, Проспект Вернадского, д. 78, Россия
* E-mail: lyudmila.shibryaeva@yandex.ru
** E-mail: komova_n@mirea.ru
Поступила в редакцию 06.08.2022
После доработки 05.09.2022
Принята к публикации 05.09.2022
- EDN: DCVKLG
- DOI: 10.31857/S0023119323010126
Аннотация
Исследовано влияние облучения гелий-неоновым лазером длиной волны 632.8 нм на вязкость водного раствора хлорида натрия. Показано, что облучение изменяет характер и численные значения концентрационной зависимости вязкости. Определены зависимости энергии активации вязкого течения от концентрации для необлученного и облученного водного раствора хлорида натрия. Проведен анализ влияния облучения на параметры степенной зависимости вязкости раствора от концентрации, определены температурные зависимости этих параметров. Сделан вывод, что лазерное облучение изменяет структурную организацию водной системы, уменьшает взаимодействие молекул воды с ионами соли. Этот процесс усиливается с увеличением температуры.
ВВЕДЕНИЕ
Большое значение для различных отраслей народного хозяйства, включая химическую, биохимическую и медицинскую технологии, сельское хозяйство, производство продуктов питания и др. имеют качества и реакционная активность водных растворов солей, определяемые структурой такой системы. Регулирование состояния и вытекающей из этого положения увеличение активности водно-солевой системы может быть решено путем энергетических воздействий на эти объекты. Проблема целенаправленного проведения активации водных растворов солей в результате энергетических воздействий является важной и актуальной. Для ее решения представляется важным рассмотреть особенности влияния лазерного воздействия на молекулярную организацию воды и водных растворов солей.
ТЕОРЕТИЧЕСКИЙ АНАЛИЗ
В растворах солей структуру и свойства определяет взаимодействие молекул растворителя и растворенного вещества. Явления переноса (в частности, возникновение внутреннего трения при истечении) в растворах связаны со структурой самой жидкости и с изменением этой структуры, происходящей под влиянием растворенного вещества. Современные модели процессов переноса за счет обмена импульсами в системе (вязкость) основаны на работах Онзагера, Борна, Грина [1], Френкеля [2], Кирквуда [3], в которых применяются методы статистической термодинамики необратимых процессов. В этих моделях жидкость представлена как набор жестких сферических молекул. В интерпретации предлагаемых теорий возникают определенные трудности вследствие того, что процессы переноса связаны с динамическими и статическими свойствами нескольких одновременно взаимодействующих молекул, которые зависят от их формы, вида, сил межмолекулярного взаимодействия между собой и с окружающей средой, а также от организации их расположения в среде. Для водных растворов ситуация усложняется тем, что молекулы воды имеют несферическую форму и обладают дипольным моментом. Эти факторы определяют такие процессы в водной системе, как: наличие диполь-дипольных взаимодействий, образование водородных мостиков, объединение в кластеры и т.п.
Изменения в молекулярной структуре воды при растворении в ней солей зависят от взаимодействия между молекулами растворенного вещества и растворителя, а также от того, каким образом молекулы растворенного вещества заполняют структурные пустоты или замещают молекулы в структуре жидкой воды, что определяется размерами молекул. Имеется существенное различие в характере влияния на свойства воды нейтральных молекул и положительно или отрицательно заряженных ионов. Электрическое поле ионов изменяет ориентацию дипольных молекул воды, искажая первоначальную структуру, а также сжимая молекулы воды (проявление электрострикции), разрушая области структурной организации молекул воды [4]. Разрушение структурной организации молекул воды наблюдается в областях, окружающих ионы, и зависит от размера ионов, а в случае достаточно больших по размерам ионов может произойти разрыв водородных связей [5, 6]. Изменение структуры воды с возможным усложнением под влиянием электрического поля ионов проявляется, главным образом, вблизи катионов [7].
В целом ряде исследований было показано различное влияние анионов и катионов на структуру воды [8]. В процессе гидратации молекула воды поворачивается отрицательным полюсом к катионам, а положительным – к анионам, что и предопределяет различное влияние двух типов ионов на структуру воды. Энергия молекулы воды около катиона минимальна, а тип связи при взаимодействии катиона с молекулой воды кардинально отличается от водородной связи. Катион, независимо от своего размера, образует при гидратации такую конфигурацию, которая позволяет ему легко внедряться в структуру окружающей воды. Поскольку катион взаимодействует с двумя парами электронов L-оболочки атома кислорода, входящего в состав молекулы воды, то молекулы воды, находящиеся в непосредственной близости с катионом, образуют связь только с другими молекулами воды [9]. Положительный полюс молекулы воды ориентируется по направлению к аниону, и поэтому расположение ближайших к аниону молекул воды зависит от размера анионов [9]. Молекула воды, присоединенная к аниону, может свободно вращаться вокруг своей связи и образовывать три водородных связи с другими молекулами воды [10, 11]. Под влиянием небольших однозарядных и многозарядных ионов образуется раствор с большей вязкостью, чем вязкость самой воды. Это является результатом увеличения протяженности областей упорядоченной структуры молекул воды вокруг ионов.
Согласно Франку и Вену [12], между двумя ионами располагается промежуточная область с неупорядоченными молекулами растворителя. Результатом взаимодействия молекул разных областей является тот факт, что ионы могут как разрушать организацию молекул воды, так и способствовать ее укреплению. Молекулы воды, окружающие растворенный ион, могут оказаться более подвижными, чем в чистой воде. Именно этим явлением объясняется повышение энтропии и уменьшение вязкости водных растворов некоторых солей по отношению к чистой воде при тех же условиях. Этот эффект получил название отрицательной гидратации [13] и объясняется нарушением структуры растворителя под влиянием больших ионов [14]. Напряженность электрического поля у границ крупных ионов относительно невелика, поэтому их поляризующее, электрострикционное и снижающее подвижность молекул воды влияние, существенно лишь в первом слое вокруг ионов. Упорядочиваются только те молекулы воды, которые расположены в слое, прилегающем к поверхности ионов, а вне этого слоя имеет место сильный разрушающий структуру эффект, повышающий подвижность молекул воды (отрицательная гидратация) [15–17].
Используя изложенные представления при анализе вязкого течения водных растворов и отклонения вязкости системы от вязкости самой воды, можно судить о структурных изменениях водной системы при введении растворимых солей и, в частности, хлорида натрия.
Вязкость водного раствора изменяется в зависимости от свойств ионов. А если в системе присутствуют и катионы, и анионы, то эффект воздействия на вязкость суммируется. В разбавленных растворах вязкость приблизительно линейно зависит от концентрации, но в очень разбавленных растворах появляется отклонение от линейности [18]. Это показывает, что проявляется эффект, который всегда приводит к повышению вязкости.
В результате изучения ряда растворов электролитов Джонс и Доул [8] установили, что при постоянной температуре справедливо эмпирическое соотношение между относительной вязкостью раствора ηотн и концентрацией электролита С:
(1)
${{\eta }_{{{\text{отн}}}}} = \frac{\eta }{{{{\eta }_{0}}}} = 1 + {\text{A}}\sqrt {\text{C}} {\text{\;}} + {\text{BC,}}$где η – вязкость раствора электролита, η0 – вязкость чистого раствора при той же температуре, А и В – константы для данного раствора, не зависящие от концентрации. Константа А всегда положительна и связана с электростатическим взаимодействием растворенных ионов между собой, константа В может быть как положительной, так и отрицательной в зависимости от свойств растворенного вещества и растворителя. Этот параметр определяет взаимодействие растворенных ионов с водой. Температурный коэффициент параметра В в большинстве случаев положительный [19]. Так для водного раствора с ионами Na+ и Cl– при 25°С по данным [8] величина В составляет 0.0793 л/моль. Теоретические расчеты показывают, что значения коэффициента В для катионов Na+ с увеличением температуры остаются неизменными и положительными, а для анионов Cl– увеличиваются, переходя из отрицательного значения в положительное [8]. Если электролит в растворе находится в полностью диссоциированном состоянии и можно пренебречь ассоциацией ионов, то взаимодействие между ионами и растворителем проявляется в виде двух процессов: сольватации ионов и воздействия ионов на структуру жидкости. При сольватации возрастает эффективный размер ионов, что приводит к росту вязкости. Степень сольватации зависит от свойств ионов: их заряда и величины. Чем больше заряд иона и меньше его радиус, тем выше степень сольватации. Ориентационная поляризация молекул воды в присутствии ионов приводит к увеличению вязкости, но электрические поля ионов вызывают деполимеризацию молекул воды, что понижает вязкость [20]. Коэффициент В будет положительным или отрицательным в зависимости от того, какой из эффектов сильнее. В основном коэффициент В имеет положительный температурный коэффициент, поскольку с повышением температуры разрушается упорядоченная структура водной системы и усиливается разрушающее действие ионов на эту структуру. Из-за частичного разрушения структуры воды возрастает число мономерных молекул, которые легче присоединяются к иону, чем молекулы, входящие в ассоциаты. Это приводит к увеличению радиуса гидратированного иона и к увеличению вязкости.
Такое качественное рассмотрение взаимодействия ионов с растворителем позволяет объяснить рост коэффициента В с ростом температуры. Разрушение структуры растворителя приводит к более быстрому уменьшению вязкости растворителя, чем вязкости раствора, где структура воды уже разрушена под действием ионов [8].
В работах [21, 22] определено влияние облучения на структуру водной системы и показано, что при облучении лазерным источником длиной волны 670 нм воды происходит уменьшение эффективного электрического сопротивления и диэлектрической проницаемости этой среды в два раза для тока частотой 120 Гц. При прохождении тока частотой 1000 Гц в процессе облучения среды относительная диэлектрическая проницаемость увеличивается, а тангенс угла диэлектрических потерь уменьшается. Эти результаты свидетельствуют о структурных изменениях водной системы при действии лазерного излучения. Структурные изменения должны происходить и в водных растворах хлорида натрия при его облучении.
Цель работы установить характер влияния лазерного облучения на структурную организацию такой составной системы, как водный раствор ионов хлора и натрия.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Измерение вязкости водного раствора хлорида натрия проводили в термостате, который поддерживал заданную температуру в пределах ± 0.1°С, на отградуированном по бидистилляту, стеклянном капиллярном вискозиметре ВПЖ-4 [23]. Пределы допускаемой относительной погрешности вискозиметра составляют не более 0.35%. Замеры производились не менее 10 раз, получали среднее значение. Время истечения жидкости в капилляре определяли с использованием замедленной съемки для достижения необходимой точности. Общая погрешность измерений, включая систематические и статистические погрешности, была на два порядка меньше, чем значения измеряемых параметров. Электромагнитное воздействие на раствор хлорида натрия проводилось гелий-неоновым лазером длиной волны 632.8 нм, мощностью 3 мВт. Облучение исследуемого раствора осуществлялось непосредственно в вискозиметре в течение 5 мин до проведения измерения и в течение всего времени проведения измерения.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
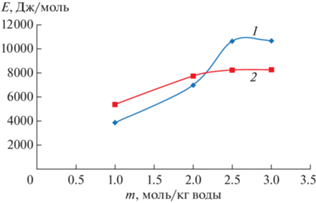
На рис. 1 показана концентрационная зависимость кинематической вязкости водного раствора хлорида натрия при 20°С до (кривая 1) и после лазерного облучения (кривая 2). Из приведенной зависимости следует, что при комнатной температуре облучение водного раствора хлорида натрия концентрацией менее 3 моль/кг воды не влияет на вязкость системы, а, следовательно, и на структуру всей водно-солевой системы. Но с повышением концентрации раствора характер таких зависимостей облученных и необлученных образцов меняется. На рис. 2 представлены зависимости энергий активации вязкого течения необлученного водного раствора хлорида натрия (1) и этого раствора после облучения (2). Для концентрации водного раствора соли менее 2 моль/кг воды энергия активации вязкого течения для необлученного раствора меньше, чем для облученного, а при более высокой концентрации ситуация изменяется. Следует также отметить разный характер представленных зависимостей на рис. 2 для облученных и необлученных образцов. Из этих результатов следует, что лазерное воздействие меняет структуру системы катионов и анионов хлорида натрия, распределенных в водной среде. В целях оценки влияния лазерного облучения на типы структурного состояния в растворе хлорида натрия определены температурные зависимости параметров уравнения Джонса–Доула: А и В для необлученного и облученного образцов, поскольку параметр В учитывает взаимодействие ионов с молекулами воды, а параметр А связан с электростатическим взаимодействием растворенных ионов между собой. Исследуя температурные зависимости этих параметров для облученных и необлученных солевых растворов, можно заключить на какой фактор состояния ионов в водной среде в наибольшей степени воздействует лазерное излучение в процессе изменения температуры.
Рис. 1.
Концентрационная зависимость кинематической вязкости водного раствора хлорида натрия при 20°С. 1 – необлученный раствор; 2 – раствор после лазерного облучения.
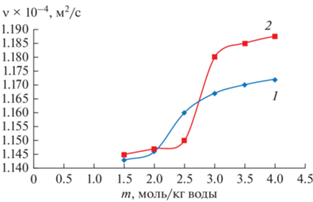
Рис. 2.
Концентрационная зависимость энергии активации вязкого течения водного раствора хлорида натрия. 1 – Раствор до облучения; 2 – раствор после облучения.
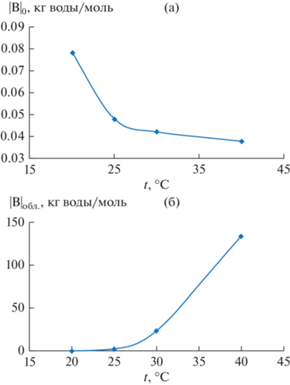
На рис. 3 показана температурная зависимость определенного коэффициента В в уравнении (1) для необлученного (рис. 3а) и облученного (рис. 3б) растворов. Характер зависимости для облученного и необлученного образцов кардинально различаются. Из представленных зависимостей следует, что с увеличением температуры происходит увеличение влияния облучения на взаимодействие молекул воды с ионами, скорее всего, в результате изменения структурной организации молекул воды под действием облучения. Температурный коэффициент, определяющий энергию активации изменения параметра В, для необлученного образца (|B|0) составляет 23.5 кДж/моль, а для облученных образцов аналогичный параметр (|B|обл.) составляет 262.7 кДж/моль. Лазерное облучение увеличивает энергию активации параметра В на порядок величины.
Рис. 3.
Температурная зависимость коэффициента В уравнения (1): (а) необлученный раствор; (б) облученный раствор.
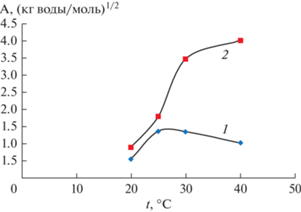
Оценить влияние облучения на взаимодействие ионов в водной среде можно по температурной зависимости коэффициента А уравнения (1) (рис. 4). Рис. 4 демонстрирует тот факт, что в наибольшей степени облучение влияет на взаимодействие катионов и анионов в водном растворе при температуре выше 25°С. Хотя значение параметра А облученного раствора в 4 раза превышает значение этого параметра в необлученном растворе при температуре 40°С, но порядок величин остается одинаковым, что не наблюдается для температурной зависимости параметра В для тех же растворов. Коэффициент А стабилизируется с повышением температуры, достигая значения 4.5 (кг воды/моль)1/2.
Рис. 4.
Температурная зависимость коэффициента А уравнения (1) необлученного водного раствора хлорида натрия (1) и облученного раствора (2).
Из полученных аналитических представлений можно заключить, что лазерное воздействие в большей степени влияет на взаимодействие ионов с молекулами воды, чем на взаимодействие ионов между собой, что объясняется наличием сольватной оболочки. Взаимодействие ионов в такой системе происходит через водную среду, которая в значительной степени изменяется под действием лазерного излучения.
ЗАКЛЮЧЕНИЕ
Показано, что облучение водного раствора хлорида натрия приводит к изменению вязкости раствора, изменяет концентрационную зависимость вязкости этой системы, а также энергию активации вязкого течения раствора. При концентрациях до 2.5 моль/кг воды воздейсвие лазерного облучения приводит к уменьшению вязкости раствора, а при более высоких концентрациях – к увеличению этого параметра, что свидетельствует об изменении степени гидратации ионов в процессе лазерного воздействия. Модуль коэффициента В формулы Джонса−Доула для необлученного раствора уменьшается с ростом температуры, оставаясь отрицательным, и температурный коэффициент этого процесса составляет 23.5 кДж/моль. Для облученных образцов модуль параметра В растет с увеличением температуры, температурный коэффициент этого процесса составляет 262.7 кДж/моль. Коэффициент А увеличивается и стабилизируется с повышением температуры для облученных образцов, его значение превышает величину аналогичного параметра для необлученных растворов максимум в 4 раза, достигая значения 4.5 (кг воды/моль)1/2. Полученные результаты указывают на тот факт, что лазерное воздействие приводит к резкому уменьшению взаимодействия молекул воды с ионами соли и к стабилизации межионных взаимодействий с повышением температуры.
Список литературы
Onsager L. // Physical Review. 1931. V. 37. P. 405.
Френкель Я.И. Кинетическая теория жидкостей. Ленинград: Наука, 1975. 582 с.
Kirkwood John G. // The Journal of Chemical Phy-sics.1946. V. 14. № 3. P 180.
Дубов Д.Ю., Востриков А.А. // Письма в ЖЭТФ. 2010. Т. 92. № 1. С. 34.
Hsieh Y.C., Inglefield P.T., Wen W.Y. // J Solution Chem. 1974. V. 3. № 3. P. 351. https://doi.org/10.1007/BF00646475
Soper A.K., Ricci M.A. // Phys. Rev. Lett. 2000. V. 84. № 13. P. 2881. http:// doi.org/ 10.1103 / PhysRevLett.84.2881
Mishima O., Stanley H.E. // Nature. 1998. V. 396. № 6709. P. 329.
Эрден-Груз Т. Явления переноса в водных растворах. М.: Мир, 1976. 427 с.
Noyes R.M. // J. Am. Chem. Soc. 1962. V. 84. P. 513. https://doi.org/10.1021/ja00863a002
Kühne T.D., Khaliullin R.Z. // Nat. Commun. 2013. V. 4. P. 1450. http:// doi.org /. PMID: https://doi.org/10.1038/ncomms245923385594
Attila R.I., Sylwester J.R. // Journal of Computational and Theoretical Nanoscience. 2010. V. 3. № 4. P. 527.
Frank H.S. // Proc. Roy. Soc. London Ser. A. 1958. V. 247. № 1251. P. 481.
Самойлов О.Я. Структура водных растворов электролитов и гидратация ионов. М.: Изд-во АН СССР, 1957. 182 с.
Лаптев Б.И., Сидоренко Г.Н., Горленко Н.П., Саркисов Ю.С., Антошкин Л.В. // Вестник новых медицинских технологий. 2015. Т. 22. № 2. P. 88.
Бродская Е.Н., Захаров В.В. // ЖФХ. 1995. Т. 69. № 6. С.1039.
Окроян Г.Р., Кушнарев Д.Ф., Калабин Г.А., Пройдаков А.Г. // Журнал структурной химии. 2002. Т. 43. № 2. С. 263.
Родникова М.Н., Засыпкин С.А., Маленков Г.Г. // Докл. АН. 1992. Т. 324. № 2. С. 368.
Крестов Г.А. // Журнал структурной химии. 1962. Т. 3. № 2. С. 137. elibrary ID: 20695754. EDN: RKXAFJ
Герцен Т.А., Любимова Н.Ю. // Наука и современность. 2013. № 24. С. 251. elibrary ID: 20695754. EDN: RKXAFJ
Oparin R.D., Fedotova M.V., Trostin V.N. // Journal of Structural Chemistry. 2002. T. 43. № 3. P.467. http:// https://doi.org/10.1023/A:1020393217332
Макаров Г.Н. // Успехи физических наук. 2017. Т. 187. № 3. С. 241.
Komova N., Kurnicki G., Sergienko Ye. // The scientific heritage. 2020. № 50 (50-3). P. 24.
ГОСТ 10028-81. Вискозиметры капиллярные стеклянные. Москва. Стандартинформ 2005. 15 с.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий


