Физикохимия поверхности и защита материалов, 2020, T. 56, № 5, стр. 530-538
Термогравиметрическое и ДСК-исследование смесей порошка алюминия с низкомолекулярными органическими соединениями после пластического деформирования под высоким давлением
В. А. Жорин 1, *, М. Р. Киселев 2, В. А. Котенев 2
1 Учреждение Российской академии наук Институт химической физики им. Н.Н. Семенова РАН
119991 Москва, ул. Косыгина, 4, Россия
2 Учреждение Российской академии наук Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119991 Москва, Ленинский пр., 31, Россия
* E-mail: vzhorin@mail.ru
Поступила в редакцию 30.11.2019
После доработки 17.03.2020
Принята к публикации 24.03.2020
Аннотация
Порошкообразные смеси алюминия с 20 мас. % органических компонентов подвергали пластическому деформированию под давлением 0.5–4.0 ГПа на аппарате высокого давления типа наковален, а затем исследовали методом термогравиметрии и ДСК. В деформированных смесях в Т-диапазоне 30–500°С происходило снижение массы, связанное с разложением органических компонентов, а в Т-диапазоне 500–800°С возрастание массы, связанное с окислением алюминия. Изменениям массы сопутствовали экзотермические эффекты. Энтальпии экзоэффектов в высокотемпературном диапазоне были всегда больше, чем в низкотемпературном диапазоне. Величины экзоэффектов зависели от содержания в органических молекулах углерода и кислорода, а в ряду органических кислот – от рН кислот.
ВВЕДЕНИЕ
Окисление металлов в воздушной среде сопровождается выделением большого количества энергии. Для получения максимальной энергии в единицу времени используют порошки металлов разной дисперсности, имея в виду, что, чем выше дисперсность порошка, тем больше его удельная поверхность. Активность порошкообразного металла будет также зависеть от структуры поверхности и от веществ, контактирующих с этой поверхностью. Интерес к процессу окисления металлических порошков связан с тем, что порошкообразные металлы оказывают сильное влияние на процессы, протекающие в твердых топливах и взрывчатых веществах.
Одним из наиболее эффективных металлов, используемых в качестве компонентов твердых топлив, является алюминий [1, 2]. В настоящее время проводятся широкие исследования процесса горения как индивидуальных порошков алюминия разной дисперсности [3], так и смесей алюминия с разными компонентами с целью интенсификации процесса горения [4]. В качестве добавок используют как порошкообразные металлы, так и органические соединения [5–8].
В работе [9] исследовали влияние нитроцеллюлозы, олеиновой и стеариновой кислоты на процесс окисления нанодисперсных порошков алюминия, а в работе [10] исследовали окисление порошкообразного алюминия после модификации поверхности формиатами Mn, Fe, Co и Ni. В работе [11] установили, что скорость окисления наночастиц алюминия с покрытием из олеиновой кислоты выше, чем с оксидным или фторполимерным покрытием, нанесенным на поверхность. В [12] было установлено, что скорость горения алюминия в нанокомпозитах алюминий-октоген тем выше, чем больше размер кристаллов октогена на частицах металла.
Эффективным методом создания свежевскрытых поверхностей в твердых талах различной химической природы является пластическое деформирование под высоким давлением на аппаратуре высокого давления типа наковален. Пластическое деформирование под высоким давлением гетерогенных смесей приводит к уменьшению размеров индивидуальных частиц, образованию свежевскрытых поверхностей и формированию протяженной межфазной границы в плоскости течения материала.
На разнородных поверхностях за счет переноса заряда из одного материала в другой (инжекции) формируются двойные электрические слои. Структурные дефекты являются ловушками для инжектированных зарядов. При пластическом деформировании увеличивается количество структурных дефектов, а высокое давление усиливает инжекцию электронов из металла наковален в диэлектрические образцы. Таким образом, не только атомы и молекулы, лежащие на поверхностях раздела, но атомно-молекулярные слои прилегающие к поверхности оказываются в поле действия сильных градиентов электрических полей. Это приведет к поляризации электронной структуры молекул органического компонента, что проявится в изменении его реакционной способности. Возможно, именно с этим эффектом связано то, что химические процессы при пластическом деформировании в различных веществах протекают без инициаторов и катализаторов. По завершению деформирования и снятия давления часть структурных дефектов с захваченными электронами выйдет из вещества, а часть останется; сохранится и межфазная граница. Таким образом, часть молекул останется в поляризованном состоянии – это может проявиться в термоинициируемых процессах в деформированных смесях. При пластическом деформировании под высоким давлением смесей металл – органический компонент сформируется плотный межфазовый контакт и органическое соединение будет препятствовать доступу кислорода к поверхности алюминия. Низкомолекулярные органические вещества широко различаются по своей химической активности – кислоты, спирты, амиды. Некоторые из них при пластическом деформировании под высоким давлением являются химически инертными, а некоторые претерпевают химические превращения. Это означает, что они могут взаимодействовать с высокоактивным алюминием уже при пластическом деформировании, образуя на поверхности алюминиевых частиц слой новых продуктов, которые могут по-разному влиять на химические процессы при последующем нагревании деформированных смесей. В этой связи представляет интерес исследование термостимулируемых процессов в металлоорганических композитах, полученных методом пластического деформирования под высоким давлением.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В данной работе в качестве объектов исследования были выбраны адамантан, антрацен, аспарагиновая кислота, янтарная кислота, малеиновая кислота, пентаэритрит, акриламид, ацетиленовая сажа и порошкообразный алюминий марки АСД8 (размер частиц 1–5 мкм). Смеси Al с 20 мас. % органических компонентов готовили в ступке. Деформирование смесей под давлением 0.5 и 1.0 ГПа проводили при комнатной температуре на наковальнях из каленой стали ХВГ с диаметром рабочих поверхностей 20 мм, а под давлением 4 ГПа на наковальнях из твердого сплава ВК6 с диаметром рабочих поверхностей 15 мм. Для анализа выбирали краевую зону образцов шириной 3–4 мм. Толщина образцов в этой зоне составляла 80–100 мкм. Изменения массы образцов при нагревании изучили на приборе Q500 TA INSTRUMENT в диапазоне 25−800°С в воздушной среде при скорости нагрева 20 град мин–1; отдельные измерения были проведены в аргоне; массу образцов варьировали от 5 до 10 мг. Были проведены также измерения на микрокалориметре Q600 TA INSTRUMENT при температурах до 800°С с одновременной записью тепловых потоков и изменений массы образцов.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Выбранные для исследования органические соединения в обычных условиях различаются по своей реакционной способности. Адамантан и антрацен малоактивные вещества, в то время как аспарагиновая, малеиновая и янтарная кислота наиболее активны в ряду органических двухосновных кислот; пентаэритрит содержит четыре активные карбоксильные группы. Перечисленные соединения не испытывают химических превращений при пластическом деформировании под высоким давлением – исключение составляет акриламид, который легко полимеризуется в этих условиях до 100% конверсии.
На температурной зависимости изменения массы для исходного алюминия в температурном диапазоне 30–450°С происходило снижение массы на 0.1%, а в диапазоне 450–800°С регистрировали увеличение массы на 0.3–0.6%, связанное с окислением алюминия. На термограммах исходного алюминия присутствует эндотермический пик плавления с максимумом при 665°С и энтальпией 300 Дж г–1; табличное значение энтальпии плавления алюминия составляет 390 Дж г–1. Различие в энтальпиях может быть связано с оксидной пленкой на поверхности алюминиевых частиц; в этом случае содержание оксида в исходном алюминии может достигать 23 мас. %.
Термическое разложение большинства исходных органических соединений и связанное с этим процессом уменьшение массы проходило в одну стадию. Конечная температура варьировалась от 200°С для адамантана до 370°С для пентаэритрита. В то же время в аспарагиновой кислоте уменьшение массы проходило в три стадии и завершалось при 760–770°С.
Температурные зависимости изменения массы в деформированных смесевых образцах состоят из двух диапазонов: в диапазоне 30–400°С происходит уменьшение массы (–м), связанное с разложением органических компонентов смесей, а в диапазоне 400–800°С регистрировали возрастание массы (+м), связанное с взаимодействием алюминия с кислородом и азотом воздуха (рис. 1).
Рис. 1.
Изменение массы при нагревании смесей (1, 3, 5, 7) и термограммы смесей (2, 4, 6, 8) содержащих 20 мас. %: адамантана (1, 2), антрацена (3, 4), янтарной кислоты (5, 6), пентаэритрита (7, 8) после деформирования под давлением 0.5 ГПа.
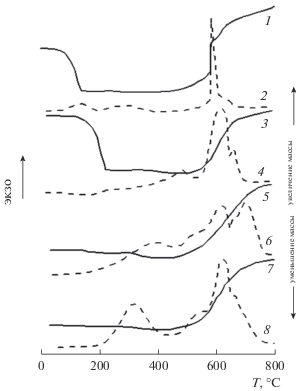
В табл. 1 приведены величины –м для разных смесей после деформирования под давлением 0.5, 1.0 и 4.0 ГПа. Во всех смесях независимо от давления обработки величины –м были меньше 20%. Не полное разложение органических компонентов при нагревании деформированных образцов может быть связано с образованием термостойких продуктов как во время деформирования, так и при нагревании смесей. Такими продуктами могут быть Al2O3, AlN, Al4C3.
Таблица 1.
Уменьшение массы (–м%, –м2%) в температурном диапазоне 30–400°С и увеличение массы (+м%) в диапазоне 400–800°С после деформирования смесей при разных давлениях (Р, ГПа)
| Р, ГПа | –м, % | –м2, % | +м, % | |
|---|---|---|---|---|
| Антрацен | 0.5 | 16.9 | 15...0 | |
| 1.0 | 7.9 | 0.5 | 17.0 | |
| 1.0 Ar | 13.4 | – | ||
| 4.0 | 1.4 | 1.5 | 7.5 | |
| Адамантан | 0.5 | 13.2 | 22.0 | |
| 1.0 | 1.5 | 26.2 | ||
| 1.0 Ar | 3.7 | – | ||
| 4.0 | 1.5 | 3.5 | ||
| Янтарная кислота | 0.5 | 1.9 | 13.2 | |
| 1.0 | 2.0 | 2.1 | 6.1 | |
| 1.0 Ar | 5.1 | – | ||
| 4.0 | 1.9 | 1.8 | 3.5 | |
| Аспарагиновая кислота | 0.5 | 3.5 | ||
| 1.0 | 3.0 | 3.0 | 9.0 | |
| 4. | 2.5 | 2.5 | 4.8 | |
| Малениновая кислота | 0.5 | 1.8 | ||
| 1.0 | 1.7 | 1.2 | 6.2 | |
| 4.0 | 1.5 | 1.7 | 2.6 | |
| Пентаэритрит | 0.5 | 1.5 | 22.4 | |
| 1.0 | 5.0 | 3.1 | 4.0 | |
| 4.0 | 3.4 | 1.3 | 16.5 | |
| Акриламид | 0.5 | 4.5 | ||
| 1.0 | 4.2 | 4.2 | 12.0 | |
| 4.0 | 2.8 | 2.8 | 6.0 |
После деформирования под давлением 0.5 ГПа значение –м для смеси с антраценом составило 16.9%, а в смеси с адамантаном 13.2%; после деформирования под давлением 1 ГПа –м в смеси с антраценом составило 7.9%, а в смеси с адамантаном 2.1%. Таким образом, потери массы в смесях с антраценом больше, чем в смесях с адамантаном – это означает, что в смесях с адамантаном образуется больше термостойких продуктов, чем в смесях с антраценом. Такая разница в поведении может быть связана с более высокой химической активностью адамантана в смеси с алюминием, по сравнению с антраценом при выбранных условиях обработки.
На примере смесей с антраценом и адамантаном видно, что значения –м уменьшаются (возрастает количество термостойких продуктов) с увеличением давления деформирования от 0.5 до 4.0 ГПа – это свидетельствует о том, что химические превращения в смесях, приводящие к образованию термостойких продуктов, протекают именно во время деформирования под давлением. В других же смесях, обработанных под давлением 4 ГПа, значения –м варьировались в пределах 1.5–3.4%, то есть практически совпадали с величинами, полученными после обработки под давлением 0.5 ГПа. Это означает, что в этих смесях практически полное расходование органических компонентов в химических процессах происходит уже при деформировании под давлением 0.5 ГПа.
По количеству образовавшихся термостойких продуктов смеси, деформированные под давлением 1 ГПа, можно выстроить в следующий ряд: адамантан (18.5%), малеиновая кислота (18.3%), янтарная кислота (18.0%), аспарагиновая кислота (17.0%), акриламид (15.8%), пентаэритрит (15.0%), антрацен (12.1%).
Среди органических соединений, выбранных для исследования, присутствуют двухосновные органические кислоты, которые различаются по своей химической активности, характеризуемой в обычных условиях константами диссоциации. По первой константе диссоциации (K1) самой сильной кислотой является малеиновая (K1 = 1000 × 10–5), затем следует аспарагиновая кислота (K1 = 750 × 10–5), а потом янтарная кислота (K1 = 6.4 × 10–5). По второй константе диссоциации (K2) ряд активности кислот выглядит по-другому: аспарагиновая кислота (K2 = 17.7 × 10–5), янтарная кислота (K2 = = 0.23 × 10–5), малеиновая кислота (K2 = 0.05 × 10–5). Приведенные данные свидетельствуют о том, что в ряду двухосновных кислот количество образующихся термостойких продуктов уменьшается по мере увеличения силы кислоты по константе K2.
Наименьшее количество термостойких продуктов (12.1%) регистрировали в антрацене, который можно рассматривать как слабую С–Н-кислоту. Если предположить, что установленное на примере ряда кислот снижение количества термостойких продуктов связано с увеличением кислотности, тогда полученному в смесях с антраценом количеству термостойких продуктов должна соответствовать константа диссоциации 454.0 × 10–5, то есть в 25 раз больше, чем K2 в сильной аспарагиновой кислоте.
Образование термостойких продуктов может происходить в процессе деформирования при взаимодействии активных атомов алюминия с молекулами органических соединений, а также с кислородом и азотом воздуха. При нагревании деформированных смесей алюминий может прореагировать с продуктами термического разложения органики, а также с кислородом и азотом воздуха. Конечными продуктами таких процессов будут Al2O3, Al(OH)3, Al4C3, AlN. В этой связи представляет интерес вопрос о том, какое количество новых продуктов образуется при окислении, карбидизации и азотировании. Для ответа на этот вопрос деформированные под давлением 1 ГПа смеси с адамантаном, янтарной кислотой и антраценом нагревали в аргоне. При измерениях в воздушной среде протекают процессы, как с участием кислорода и азота воздуха, так и с участием углерода. При измерениях в аргоне будут исключены процессы окисления и азотирования, а основным химическим процессом будет взаимодействие атомов алюминия на свежевскрытой поверхности металлических частиц с атомами углерода органических компонентов.
Оказалось, что при измерениях в аргоне смесей с антраценом, адамантаном и янтарной кислотой количество вылетающих продуктов было больше, чем при измерениях в воздушной среде. По данным, приведенным в табл. 1, можно определить количество термостойких продуктов, образующихся в температурном диапазоне разложения органических соединений, как в воздушной среде, так и в аргоне. Количеству карбидов соответствует количество термостойких продуктов образующихся при измерениях в аргоне; для адамантана, янтарной кислоты и антрацена эти величины составили 16.3, 14.9 и 6.6%, соответственно. Разница между количеством термостойких продуктов, полученных при измерениях в воздушной среде и в аргоне, дает суммарное количество продуктов окисления и азотирования, которое для адамантана составило 2.2%, для янтарной кислоты – 3.1%, а для антрацена – 5.5%. В случае смеси с антраценом количество термостойких продуктов, которые можно связать с образованием карбида алюминия (6.6%), в 1.2 раза превышает количество термостойких продуктов, образование которых произошло при окислении и азотировании алюминия (5.5%); в случае смеси с адамантаном количество образующегося карбида (16.3%) в 7.4 раза превышает суммарное количество нитридов и оксидов (2.2%); в смеси с янтарной кислотой количество карбида (14.9%) в 4.8 раза превышает суммарное количество продуктов окисления и азотирования (3.1%). Таким образом, во всех смесях после обработки под давлением и нагрева до 450–500°С содержание карбида превышает содержание оксида и нитрида алюминия.
Молекула антрацена в своем строении содержит 94% углерода; в молекуле адамантана углерода содержится 88%, а в молекуле янтарной кислоты – 41%. На основе этих данных можно оценить “активность” атомов углерода в разных соединениях как отношение количества образовавшегося карбида к содержанию углерода в органической молекуле. Для антрацена, адамантана и янтарной кислоты эти величины составили 0.07, 0.18 и 0.36, соответственно. Таким образом, в низкотемпературной области, “активность” углерода в янтарной кислоте в 5.3 раза выше, чем в антрацене и в 2 раза выше, чем в адамантане.
Во всех смесях, деформированных под давлением 1 и 4 ГПа, при измерении в воздушной среде, в температурном диапазоне 450–530°С регистрировали второй этап снижения массы (–м2), сразу после которого начиналось увеличение массы, связанное с окислением алюминия. Исключение составила смесь с адамантаном, в которой сразу по завершению основного процесса разложения органической фазы начиналось увеличение массы образцов (после 0.5 ГПа этого этапа не было). Величины –м2 различались для смесей с разными органическими компонентами (табл. 1), но мало отличались от значений –м: так после деформирования под давлением 1 ГПа минимальное значение –м2 = 0.5% было получено для смеси с антраценом, а максимальное – для смеси с акриламидом (4.2%). Возможно, что снижение массы в металлополимерных смесях в диапазоне 450–530°С связано с частичным распадом термостойких продуктов образовавшихся, как при деформировании под давлением, так и при взаимодействии продуктов разложения органического компонента с атомами алюминия на свежевскрытой поверхности металлических частиц.
В Т-диапазоне 50–450°С происходит полное разложение органических компонентов и в смеси остается алюминий и образовавшиеся термостойкие продукты. К началу интенсивных процессов окисления и азотирования при температурах выше 500°С на поверхности металлических частиц формируются слои из термостойких продуктов, образовавшихся при взаимодействии органических компонентов смесей с активными атомами алюминия на свежевскрытых поверхностях алюминия, как во время деформирования, так и при взаимодействии продуктов разложения органических веществ с алюминием при нагревании. Таким образом, влияние органических компонентов на процессы окисления и азотирования при высоких температурах, скорее всего, надо искать в элементном составе исследуемых органических соединений.
В табл. 2 приведены данные о приращении массы в деформированных смесях в температурном диапазоне 500–800°С. Максимальное приращение массы после деформирования под давлением 1 ГПа достигало +м = 26.2% в смеси с адамантаном, а минимальное +м = 4% было зарегистрировано в смеси с пентаэритритом. В табл. 2 приведены также данные по элементному составу органических компонентов смесей, которые свидетельствуют о том, что значения +м уменьшаются по мере снижения в органических компонентах углерода и увеличения содержания кислорода. На рис. 2 показано влияние кислорода на величину +м в разных смесях.
Таблица 2.
Элементный состав органических соединений и увеличение массы (+м, %) в деформированных смесях
| +м,% | С, % | О, % | N, % | Н, % | |
|---|---|---|---|---|---|
| Адамантан | 26.2 | 88 | 0 | 0 | 12 |
| Антрацен | 17.2 | 94 | 0 | 0 | 6 |
| Акриламид | 12.0 | 48 | 21 | 23 | 7 |
| Аспарагиновая к-та | 9.0 | 39 | 35 | 18 | 6 |
| Янтарная к-та | 6.4 | 41 | 43 | 0 | 8 |
| Малеиновая к-та | 6.1 | 50 | 44 | 0 | 5 |
| Пентаэритрит | 4.0 | 46 | 49 | 0 | 3 |
Рис. 2.
Зависимость приращения массы (+м, %) в Т‑диапазоне 450–800°С от содержания кислорода в органической молекуле.
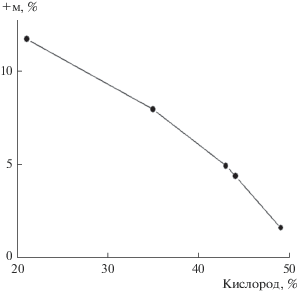
В ряду двухосновных кислот значения +м уменьшаются по мере уменьшения константы диссоциации K2. В паре азотсодержащих соединений (акриламид, аспарагиновая кислота) оказалось, что, чем больше содержание азота, тем больше значение +м.
Таким образом, величина +м зависит не только от элементного состава органических молекул, а в ряду органических кислот и от величины константы диссоциации. Кислоты оказывают противоположное влияние на изменения массы в деформированных смесях: так в Т-диапазоне разложения органики количество образующихся термостойких продуктов снижается с увеличением силы кислоты, а в Т-диапазоне интенсивного окисления алюминия приращение массы возрастает с увеличением силы кислоты. Наиболее сильное влияние на процессы приводящие к изменениям массы проявляют слабые С–Н-кислоты.
Известно, что растворы спирооксазина при УФ-облучении приобретают синюю окраску, а в кислой среде окраска становится красной (солевая форма). В работе [13] было показано, что в результате пластического деформирования под давлением 1 ГПа спирооксазин окрашивается в синий цвет. В результате деформирования под высоким давлением смеси спирооксазана с кислотами (малеиновой, фумаровой) приобретали красную окраску. Красным же был и цвет деформированной смеси спирооксазина со слабой N–H-кислотой – акриламидом. Образование солевой формы (красную окраску) наблюдали также в деформированной смеси с полиэтиленом. Таким образом, при пластическом деформировании под высоким давлением кислотные свойства (способность протонировать) может проявлять и полиэтилен.
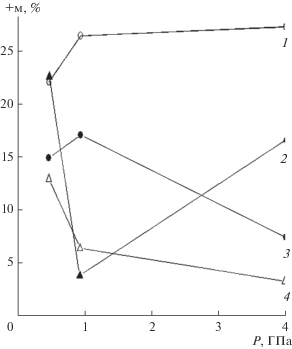
На рис. 3 представлены значения +м для разных смесей в зависимости от давления деформирования. В случае смеси с адамантаном величины +м достигала максимального значения (26.2%) при давлении 1 ГПа и далее не зависела от давления обработки. Зависимость для смеси с пентаэритритом имела ярко выраженный экстремальный характер с минимумом при давлении 1 ГПа. Для смесей с антраценом и янтарной кислотой также было зарегистрировано нарушение монотонности на барических зависимостях.
Рис. 3.
Зависимость приращения массы (+м, %) в Т‑диапазоне 450–800°С в смесях с адамантаном (1), пентаэритритом (2), антраценом (3) и янтарной кислотой (4) в зависимости от давления деформирования Р, ГПа.
Химические реакции, протекающие в смесевых образцах при нагревании, должны сопровождаться выделением тепла. Для изучения этих процессов смеси с адамантаном, антраценом, янтарной кислотой и пентаэритритом исследовали методом ДСК с одновременной записью m–T-зависимостей. Деформирование смесей проводили под давлением 0.5 ГПа – в этом случае в образцах будет оставаться максимальное количество не прореагировавшей под давлением органики и максимальным же будет приращение массы в высокотемпературном диапазоне; таким образом можно ожидать, что экзотермические эффекты проявятся в наибольшей степени.
На рис. 1 приведены термограммы деформированных смесей и соответствующие им m–T-зависимости, полученные в воздушной среде. На термограммах всех смесей в диапазоне 30–500°С присутствуют экзотермические пики, проявляющиеся при температурах, при которых на m–T-зависимостях происходит снижение массы, а в диапазоне 500–800°С присутствуют экзотермические пики, которым на m–T-зависимостях соответствует интенсивное увеличение массы. Характерно то, что и увеличение массы и экзотермические пики наиболее сильно проявляются при температурах ниже Тпл алюминия; при более высоких температурах скорость приращения массы заметно снижается.
Следует отметить, что термическое разложение низкомолекулярных органических соединений использованных в данной работе сопровождается эндотермическими эффектами, энтальпии которых в ряду пентаэритрит–адамантан–антрацен–янтарная кислота составляют 1100–100–580–1300 Дж г–1. Изменение знака теплового эффекта при разложении органического компонента в деформированной смеси может быть связано с выделением энергии при взаимодействии продуктов разложения органики с атомами алюминия на свежевскрытых поверхностях металлических частиц.
Экзотермические пики на термограммах частично перекрывались и для оценки их энтальпий использовали метод графического разделения. В табл. 3 приведены энтальпии экзотермических процессов в температурном диапазоне разложения органической фазы и в диапазоне увеличения массы, связанным с окислением; расчет энтальпий проводили на полную массу образцов. При такой обработке энтальпии экзопроцессов в низкотемпературном диапазоне варьировались от 300 Дж г–1 в янтарной кислоте до 1300 Дж г–1 в пентаэритрите. В высокотемпературном диапазоне минимальное значение энтальпии было получено в смеси с антраценом и составило 2400 Дж г–1, а максимальное – в смеси с пентаэритритом и достигало 4200 Дж г–1.
Таблица 3.
Количество образовавшихся термостабильных продуктов (% термост.), энтальпия экзопроцесса (∆НI, Дж/г) и приведенная энтальпия (∆НIприв) в Т-диапазоне 50–450°С; приращение массы (+м, %), энтальпия экзопроцесса (∆НII, Дж/г) и приведенная энтальпия (∆НIIприв) в Т-диапазоне 450–800°С
| % термост | ∆НI, Дж/г | ∆НIприв | +м, % | ∆НII, Дж/г | ∆НIIприв | |
|---|---|---|---|---|---|---|
| Пентаэритрит | 18.6 | 1300 | 70 | 4.0 | 4100 | 1025 |
| Адамантан | 6.8 | 410 | 60 | 26.2 | 2780 | 106 |
| Антрацен | 3.1 | 380 | 122 | 16.0 | 2400 | 150 |
| Янтарная кислота | 18.1 | 300 | 17 | 13.4 | 3000 | 224 |
Данные табл. 3 свидетельствуют о том, что эгерговыделение в низкотемпературном диапазоне ниже, чем в высокотемпературном. Наибольшие величины экзотермического эффекта в обоих температурных диапазонах были зарегистрированы в пентаэритрите – веществе с максимальным содержанием кислорода в молекуле.
Экзотермическим эффектам для разных смесей соответствовали разные изменения массы. Для более корректного сравнения энергетических процессов в деформированных металлоорганических смесях измеренные энтальпии экзоэффектов относили к соответствующему изменению массы (“приведенная” энтальпия) – уменьшению в низкотемпературном диапазоне и увеличению в высокотемпературном (∆НIприв и ∆НIIприв); полученные значения приведены в табл. 3.
В паре антрацен–адамантан величина ∆НIприв коррелирует с содержанием углерода в органической молекуле; в паре пентаэритрит–янтарная кислота значение ∆НIприв тем больше, чем выше содержание углерода в молекуле, и чем ниже содержание кислорода. Янтарная кислота наиболее химически активна, а значение ∆НIприв самое маленькое. Этот эффект, возможно, связан с тем, что часть термостойких продуктов образовалась уже при деформировании, а экзоэффект относиться к химическому процессу при нагревании.
Табличное значение энтальпии плавления Al составляет 390 Дж г–1, а энтальпия плавления использованного в нашей работе порошка не превышала 300 Дж г–1; такое различие может быть связано с частичным окислением используемого алюминиевого порошка. Для исследуемого порошка “приведенная” энтальпия составляет 144. Таким образом, для смеси с пентаэритритом “приведенная” энтальпия в 7 раз больше, а для смеси с янтарной кислотой в 1.5 раза больше, чем для исходного алюминия. Эффект увеличения “приведенной” энтальпии характерен только для кислородсодержащих органических соединений. В смесях с антраценом и адамантаном “приведенная” энтальпия либо совпадала с аналогичной характеристикой для исходного алюминия, либо была меньше.
Основным продуктом, образующимся при разложении органических соединений, является углерод. Однако, тот факт, что органические соединения при нагревании теряют 100% массы, означает, что углерод полностью сгорает уже при 400–450°С. Представляло интерес исследовать смесь алюминия с углеродом после деформирования под высоким давлением. С этой целью обработке под давлением 1 ГПа подвергали смесь Al–20 мас. % ацетиленовой сажи.
В исходной смеси Al–сажа снижение массы начиналось уже при 40–50°С и при 630°С составило 0.5%; при 680°С снижение массы достигало 2%, а снижение в 18% регистрировали при 780°С. Таким образом, углерод, образующийся при разложении органических соединений, сгорает при температурах до 450°С, а ацетиленовая сажа при значительно более высокой температуре – выше 780°С. В смеси Al–сажа обработанной под давлением 1 ГПа снижение массы при 700°С составило 3.8%, а возрастание массы при 800°С составило 0.9%.
На термограмме деформированной смеси Al–углерод присутствовали экзотермические пики, на которые накладывался эндотермический пик плавления алюминия, максимум которого находился при 650°С, а энтальпия составила 15.5 Дж г–1. Температура плавления используемого нами порошка алюминия составляла Тпл = 662°С. Согласно данным работы [14] снижение Тпл алюминия на 12 град свидетельствует о том, что размер частиц металла уменьшился до 140–150 нм. Энтальпия плавления исходного порошкообразного алюминия не превышала 300 Дж г–1 – это означает, что энтальпия плавления 80 мас. % Al должна составить 240 Дж г–1, а в деформированной смеси энтальпия плавления алюминия составила лишь 15.5 Дж г–1 – такая энтальпия соответствует плавлению только 6.5% алюминия.
Суммарная энтальпия экзотермических процессов в деформированной смеси составила 3210 Дж г–1. Экзо процессы в деформированной смеси идут с очень маленькими изменениями массы. Это означает, что выделение энергии не связано с окислением алюминия. Скорее всего, экзотермические эффекты связаны с взаимодействием алюминия и углерода. Энтальпия образования карбида алюминия составляет 209 кДж/моль = 1.45 кДж/г, а суммарная энтальпия экзопроцессов в смеси достигает 3.21 кДж/г. Возможно, что наряду с образованием карбида алюминия происходит образование интеркалляционных комплексов – внедрение атомов алюминия в межслоевые пространства графита – это и дает дополнительный вклад в суммарную энергию.
ЗАКЛЮЧЕНИЕ
При деформировании бикомпонентных смесей под высоким давлением пластические деформации развиваются в обоих компонентах. В случае смесей алюминий–20 мас. % органического компонента частицы металла дробятся до размера 140–150 нм. При этом на частицах металла образуется высоко активная свежевскрытая поверхность. Такие изменения способствуют протеканию в деформируемых смесях химических процессов между молекулами органического компонента и атомами алюминия. О химическом взаимодействии в деформируемых смесях свидетельствует почернение образцов, а также то, что количество образующихся термостойких продуктов возрастает с увеличением давления обработки.
Термостимулируемые процессы в деформированных металлоорганических смесях протекают в двух Т-диапазонах. В диапазоне 30–500°С это связано с разложением органических компонентов, а в диапазоне 500–800°С с окислением алюминия. Энтальпии экзопроцессов в низкотемпературном диапазоне были всегда меньше, чем энтальпии экзопроцессов в высокотемпературном диапазоне.
В деформированных смесях потери массы были всегда меньше 20%, что указывает на образование термостабильных продуктов.
При нагревании деформированных смесей в температурном диапазоне 30–500°С регистрировали снижение массы, связанное с разложением органики, а в диапазоне 500–800°С увеличение массы, связанное с окислением и азотированием алюминия. Изменения массы в смесях сопровождались химическими процессами, которым на термограммах соответствовали экзотермические пики.
Количество образующихся термостойких продуктов в Т-диапазоне разложения органики в ряду двухосновных органических О–Н-кислот уменьшается при увеличении силы кислоты. Наиболее сильным снижение количества термостойких продуктов оказалось в смесях со слабыми в обычных условиях N–H- и С–Н-кислотами. В обычных условиях активность аспарагиновой кислоты в 350 раз выше, чем малеиновой, а в деформированных смесях различие сокращается до 1.07 раза. Такой эффект может быть связан с формированием на границах разнородных фаз двойных электрических слоев. В этом случае органические молекулы оказываются в поле действия сильных электрических полей, способных поляризовать электронную структуру молекул. Уменьшение различий в химической активности кислот возможно в том случае когда суммарная поляризация молекул кислот – эффект от влияния электрических полей и естественная поляризация органических молекул – будет существенно превышать поляризацию молекул в обычных условиях.
Количество термостойких продуктов в диапазоне 500–800°С, когда основными образующимися продуктами являются оксиды и нитриды алюминия, тем больше, чем больше содержание углерода в органических молекулах; присутствие кислорода в строении органических молекул снижает количество образующихся термостойких продуктов.
Работа выполнена за счет субсидии, выделенной ИХФ РАН на выполнение государственного задания; тема 0082-2014-0015 “Разработка методологии синтеза новых высокополимеров, олигомеров и макромономеров и изучение влияния структуры полимеров на их свойства”; АААА-А17-117032750201-9; а также в рамках госзадания ИФХЭ РАН по теме госзадания “Физикохимия функциональных материалов на основе архитектурных ансамблей металл-оксидных наноструктур, многослойных наночастиц и пленочных нанокомпозитов”. Регистрационный номер НИОКТР АААА-А19-119031490082-6.
Список литературы
Иванов В.Г., Гаврилюк О.В. // Физика горения и взрыва. 1999. Т. 35. № 6. С. 53–60.
Ильин А.П., Громов А.А., Яблуновский Г.В. // Физика горения и взрыва. 2001. Т. 37. № 4. С. 58–62.
Сандарам Д., Янг В., Зарко В.Е. // Физика горения и взрыва. 2015. Т. 51. № 2. С. 37–63.
Громов А.А., Попенко Е.М., Ильин А.П. // Химическая физика. 2005. Т. 24. № 4. С. 69–83.
Dreizin E.L., Shosin Yu.L., Mudryy R.S., Hoffman V.K. // Cobustion and Flame. 2002. V. 130. P. 381–387.
Брейтлер А.Л., Мальцев В.М., Попов Е.И. // Физика горения и взрыва 1990. Т. 26. № 1. С. 97–104.
Шевченко В.Г., Кононенко В.И., Булатов М.Л., Латош И.Н., Чупова И.А. // Физика горения и взрыва. 1998. Т. 34. № 1. С. 45.
Жорин В.А., Киселев М.Р., Котенев В.А. // Физикохимия поверхности и защита материалов. 2019. Т. 55. № 4. С. 350–358.
Громов А.А., Ильин А.П., Бозе-Бат У., Тайпель У. // Физика горения и взрыва. 2006. Т. 42. № 2. С. 61–69.
Шевченко В.Г., Красильников В.Н., Еселевич Д.А., Конюкова А.В. // Физикохимия поверхности и защита материалов. 2019. Т. 55. № 1. С. 25–32.
Lewis W.K., Rumchik C.G., Smith M.J., Fernando K.A.S., Crouse C.a., Spowart J.E., Guliants E.A., Bunker C.E. // J. Appl. Phys. 2013. V. 113. P. 044907-1-5. https://doi.org/10.1063/1.4790159
Жигач А.Н., Лейпунский И.О., Пивкина А.Н., Муравьев И.В., Моногаров К.А., Кусков М.Л., Афанасенкова Е.С., Березкина Н.Г., Пшечков П.А., Брагин А.А. // Физика горения и взрыва. 2015. Т. 51. № 1. С. 117–124.
Жорин В.А., Зеленецкий А.Н., Киселев М.Р., Маревцев В.С., Шиенок А.И. // Журн. прикладной химии. 2005. Т. 78. № 6. С. 977–983.
Lai S.L., Carlsson J.R.A., Allen L.H. // Appl. Physics Letters. 1988. V. 72. P. 1098–1100.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов


