Физикохимия поверхности и защита материалов, 2022, T. 58, № 4, стр. 433-441
Модификация поверхности стекла силатранил-дигидропирановым гибридом: подход к новым комплекообразующим и био-функциональным материалам
Е. Н. Оборина 1, *, Н. В. Вчисло 1, Е. А. Верочкина 1, С. Н. Адамович 1
1 Иркутский институт химии им. А.Е. Фаворского Сибирского отделения Российской академии наук
Иркутск, Россия
* E-mail: oborina@irioch.irk.ru
Поступила в редакцию 03.03.2021
После доработки 30.03.2022
Принята к публикации 06.04.2022
- EDN: EYAFWJ
- DOI: 10.31857/S0044185622040155
Аннотация
На основе 1-(3-аминопропил)силатрана (1) и 2,5-дибутилтио-2,3-дигидро-2-формил-4Н-пирана, “дибутирина” (2), синтезировано новое силатранил-дигидропирановое соединение (3). Из гибридного силатрана (3) получены Cd(II) и Cu(II) комплексы (4–7), а также образцы модифицированного стекла (8). Соединения (3–8) охарактеризованы методами элементного анализа, ИК и 1Н, 13С ЯМР-спектроскопии. Изучены противомикробные свойства полученных соединений.
ВВЕДЕНИЕ
Кремнийорганические эфиры триэтаноламина, 1-органилсилатраны, R-Si(OCHRCH2)3N, представляют собой известный класс трициклических соединений пентакоординированного кремния (рис. 1) [1–5].
Уникальная структура силатранов придает им особые химические, физические свойства [2–4], а также высокую и разнообразную биологическую (физиологическую, фармакологическую) активность [5, 6]. Например, 1-(3-аминопропил)силатран и его производные оказывают противомикробные [7, 8], противопаразитарные [9], антигепатитные B [10], противоопухолевые [11], иммуномодулирующие [12] и ростстимулирующие [13] действия. Кроме того, 1-органилсилатраны недавно были успешно использованы для модификации различных поверхностей. Так, 3‑аминопропилсилатран, 3-меркаптопропилсилатран и их производные при мягком гидролизе образуют идеальные по морфологии, чрезвычайно стабильные, функциональные кремнийорганические монослои на металлах, стекле, полимерах, хлопке и др. Такие модифицированные материалы могут применяться для производства устойчиво окрашенных нелиняющих тканей, противообрастающих покрытий, гибких схем и биосенсоров, а их металлокомплексы использоваться в гетерогенном катализе [14–18].
Дигидропираны являются основой природных и синтетических биологически активных соединений, таких как амбрутицин, форбоксазол, лейкаскандролид, кендомицин, неопелтолид и диоспонин. Замещенные дигидропираны также используются в качестве вкусовых или ароматических добавок для пищевых и других продуктов [19, 20].
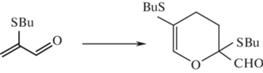
В Иркутском институте химии СО РАН реакцией димеризации синтезирован оригинальный дигидропиран, содержащий альдегидную группу, а именно, 2,5-дибутил-тио-2,3-дигидро-2-формил-4Н-пиран, получивший название “Дибутирин” (рис. 2).
Установлено, что дибутирин обладает широким спектром антигрибкового и антимикробного действия. Комплексная оценка микробиологических и токсикологических свойств показала, что дибутирин является нетоксичным веществом, а также одним из наиболее эффективных антибиотических и антисептических средств [21–23].
Сравнить дибутирин по действию на стафилококк с известными антибиотиками и антисептиками позволяет табл. 1.
Таблица 1.
Средние МИК (мкг/мл) антибиотиков и антисептиков для выборок внебольничных и больничных штаммов S. аureus
| Антибиотик | х ± S, мкг/мл | Антисептик | х ± S, мкг/мл | ||
|---|---|---|---|---|---|
| внебольничные (n = 145) | больничные (n = 149) |
внебольничные (n = 150–192) | больничные (n =134–150) | ||
| Бензилпенициллин | 105 ± 8.1 | 1867 ± 39.4 | Хлоргексидин | 5.0 ± 0.5 | 6.0 ± 0.2 |
| Оксациллин | 17.8 ± 3.9 | 953 ± 68.6 | Дибутирин | 1.3 | 1.5–3.1 |
| Ампициллин | 192 ± 20.9 | 717 ± 61.7 | Этоний | 120 ± 3.0 | 450 ± 60 |
| Эритромицин | 560 ± 69.7 | 1700 ± 51.6 | Декаметоксин | 40 ± 0.2 | 40 ± 0.1 |
| Олеандомицин | 592 ± 71.1 | 1525 ± 65.8 | Диоксидин | 2630 ± 70 | 2120 ± 70 |
| Линкомицин | 151 ± 40.3 | 1735 ± 52.9 | Йодопирон | 1000 ± 3.0 | 1000 ± 3.0 |
| Тетрациклин | 31.9 ± 1.3 | 313 ± 15.6 | Первомур | 90 ± 1.0 | 96 ± 2.0 |
| Стрептомицин | 524 ± 62.3 | 1847 ± 39.3 | Резорцин | 5600 ± 10 | 5420 ± 20 |
| Мономицин | 23.5 ± 5.2 | 715 ± 34.7 | Борная кислота | 2500 ± 100 | 3720 ±300 |
| Гентамицин | 7.1 ± 0.04 | 553 ± 60.2 | Риванол | 460 ± 60 | 910 ± 130 |
Анализ результатов собственных исследований свидетельствует, что по активности и безопасности дибутирин находится на уровне наилучших современных антисептиков и даже превосходит их.
Молекулярная гибридизация (МГ) это один из современных подходов к рациональной разработке новых лекарств или материалов, когда химические объекты получают путем объединения двух фармакофорных или функциональных единиц в одну молекулу [24–26].
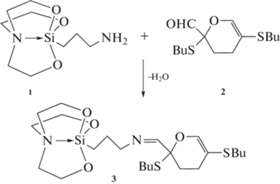
Мы предположили, что метод МГ, может привести к объединению уникальных свойств 1-(3-аминопропил)силатрана (1) и 2,5-дибутилтио-2,3-дигидро-2-формил-4Н-пирана (2).
Известно, что альдегиды и первичные амины реагируют с образованием иминов (азометинов). Существуют лишь единичные примеры взаимодействия (1) с альдегидами (салициловым альдегидом) [27, 28]. При этом образуются силатраны, содержащие в заместителе R основание Шиффа, т.е азометиновую/иминную группу С=N. Наличие такой группы способствует, например, комплексообразованию с металлами [29].
Целью работы является синтез связанного иминным линкером гибридного силатранил-дигидропиранового каркаса (3), его металлических комплексов с Cd и Cu (4–7), а также получение с помощью силатрана (3) функциональной пленки на поверхности стекла.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и методы
Растворители (ТГФ, СН2Сl2, CHCl3 и МеОН), перед использованием очищали согласно [30]. Хлориды и ацетаты металлов Cd и Cu приобретали у Sigma-Aldrich.
Исходные соединения, 1-(3-аминопропил)силатран (1) синтезировали по методике [27], 2,5-дибутилтио-2,3-дигидро-2-формил-4Н-пиран (2) получали способом описанным в патенте [22].
ИК-спектры регистрировали на ИК-Фурье-спектрометре Varian 3100 в диапазоне 4000–400 см–1.
Спектры ЯМР 1H и 13C записывали в CDCl3 при комнатной температуре на спектрометре Bruker DPX-400 (400.13 и 100.61, соответственно).
Элементный анализ проведен на Thermo Finnigan Flash 1112.
Общая методика синтеза соединения (3)
Смесь силатрана 1 (1 ммоль) и альдегида 2 (в соотношении 1 : 1) в TГФ, CHCl3 или CH2Cl2 в присутствии сит 4 Å или MgSO4 перемешивали при комнатной температуре в течение 1–3 ч. Сита отфильтровывали, растворитель отгоняли, остаток многократно промывали диэтиловым эфиром и высушивали в вакууме. Получали силатран (3) в виде маслообразной жидкости.
Общий синтез металлических комплексов (4–7)
Смесь силатрана (3) (2 ммоль), хлорида или ацетата металла Cd, Cu (1 ммоль) в МеОН перемешивали при комнатной температуре в течение 1–3 ч. Растворитель отгоняли, остаток многократно промывали диэтиловым эфиром и высушивали в вакууме. Получали комплексы (4–7) состава 2 : 1.
Получение модифицированного стекла (8)
Процедуру проводили способом погружения стеклянных пластинок в раствор подобно методике [14]. А именно, стеклянные пластинки размером 5 × 1 см очищали мылом, обрабатывали ультразвуком (Sonorex TK52) последовательно в метаноле, ацетоне, воде по 15 мин на каждой стадии, высушивали при 80°С. Очищенные стекла погружали в 5% раствор метанол/вода (1 : 1) силатрана (3) на 12 ч, затем промывали метанолом и дистиллированной водой, высушивали при 80°С. Получали образцы модифицированного стекла (8).
Микробиологические исследования
Для оценки роста микроорганизмов (Staphylococcus aureus, Pseudomonas aeruginosa, Escherichia coli) после контакта с исходным силатраном (3) и комплексными соединениями (5, 6), а также поверхностью модифицированного стекла (8) применяли метод секторных посевов (Gould method) [31, 32].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Как видно из схемы 1 , синтез гибридного силатрана (3) представляет собой простой одностадийный процесс.
Соединение (3) – желтое масло. Выход 88% (в СН2Сl2), 90% (в CHCl3), 92% (в TГФ). ИК-спектр, ν, cм–1: 1626 (C=N), 1456 (C=C), 1365 (NCH2), 1276 (OCH2), 1051 (Si–O), 769 (SCH2). 1H ЯМР (CDCl3, 400 MГц) δ: 0.31 (м, 2Н, SiCH2), 0.82 (м, 6H, 2CH3 (2Bu)), 1.33 (м, 4H, СН2CH3(2Bu)), 1.45 (м, 4H, 2SСН2СН2 (Bu)), 1.66 (м, 2H, NСН2СН2), 2.03 (м, 2H, CH2 (при С-4)), 2.10 и 2.36 (м, 2Н, CH2 (при С-3)), 2.44–2.51 (м, 4Н, 2SCH2 (2Bu)), 2.73 (м, 6H, NСН2), 3.40 (т, 2Н, J = 7.4 Гц, =NСН2), 3.66 (м, 6Н, ОСН2), 6.58 (с, 1Н, =СН(О)), 7.43 (с, 1Н, N=CH). 13C ЯМР (CDCl3, 101.6 MГц) δ: 13.6 (SiCH2), 13.68 (СН3 (2Me (Bu)), 21.55 (CH2CH3 (Bu при С*)), 22.02 (CH2CH3 (Bu при C=), 23.75 (C-3), 26.32 (NСН2СН2), 27.38 (SCH2 (Bu при С*)), 29.75 (С-4), 31.42 (SCH2СН2 (Bu при С*)), 31.77 (SCH2СН2 (Bu при С=)), 32.28 (SCH2 (Bu при С=), 51.11 (NCH2 (сил)), 57.74 (OCH2), 64.18 (NCH2), 84.63 (С*), 106.85 (С-5), 144.10 (=CHO), 160.04 (CH=N).
Найдено, %: С, 54.98; Н, 8.37; N, 5.58. С23H42N2O4S2Si.
Вычислено, %: С, 54.96; Н, 8.38; N, 5.58.
Таким образом, совокупность данных элементного анализа, ИК и ЯМР-спектроскопии подтверждает образование гибридного силатрана (3), содержащего азометиновую группировку.
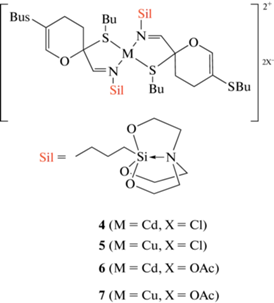
Синтез металлических комплексов (4–7) представляет собой простую процедуру (см. экспериментальную часть).
Комплекс (4). Бесцветный порошок, выход 96%. ИК-спектр, ν, cм–1 1662 (C=N), 1453 (C=C), 1365 (NCH2), 1272 (OCH2), 1051 (Si–O), 764 (SCH2). 1H ЯМР (CDCl3, 400 MГц) δ: 0.35 (м, 2Н, SiCH2), 0.85 (м, 6H, 2CH3 (2Bu)), 1.35 (м, 4H, СН2CH3(2Bu)), 1.47 (м, 4H, 2SСН2СН2 (Bu)), 1.68 (м, 2H, NСН2СН2), 2.04 (м, 2H, CH2 (при С-4)), 2.14 и 2.34 (м, 2Н, CH2 (при С-3)), 2.48–2.55 (м, 4Н, 2SCH2 (2Bu)), 2.76 (м, 6H, NСН2), 3.44 (т, 2Н, J = 7.4Гц, =NСН2), 3.71 (м, 6Н, ОСН2), 6.63 (с, 1Н, =СН(О)), 7.48 (с, 1Н, N=CH). 13C ЯМР (CDCl3, 101.6 MГц) δ: 13.68 (SiCH2), 13.75 (СН3 (2Me (Bu)), 21.64 (CH2CH3 (Bu при С*)), 22.09 (CH2CH3 (Bu при C=), 23.79 (C-3), 26.36 (NСН2СН2), 27.48 (SCH2 (Bu при С*)), 29.80 (С-4), 31.49 (SCH2СН2 (Bu при С*)), 31.80 (SCH2СН2 (Bu при С=)), 32.35 (SCH2 (Bu при С=), 51.18 (NCH2 (сил)), 57.81 (OCH2), 64.16 (NCH2), 84.70 (С*), 107.03 (С-5), 144.03 (=CHO), 160.42 (CH=N).
Найдено, %: С, 46.60; Н, 7.14; N, 4.75. С46Н84N4O8S4Si2CdCl2.
Вычислено, %: С, 46.62; Н, 7.10; N, 4.73.
Комплекс (5). Зеленый порошок, выход 96%. ИК-спектр, ν, cм–1 1651 (C=N), 1459 (C=C), 1365 (NCH2), 1272 (OCH2), 1051 (Si-O), 764 (SCH2). ЯМР спектры получить не удается из-за парамагнитности атомов меди.
Найдено, %: С, 48.46; Н, 7.36; N, 4.93. С46Н84N4O8S4Si2CuCl2.
Вычислено, %: С, 48.46; Н, 7.37; N, 4.91.
Комплекс (6). Бесцветный порошок, выход 96%. ИК-спектр, ν, cм–1 1660 (C=N), 1453 (C=C), 1365 (NCH2), 1272 (OCH2), 1051 (Si–O), 764 (SCH2).1H ЯМР (CDCl3, 400 MГц) δ: 0.34 (м, 2Н, SiCH2), 0.86 (м, 6H, 2CH3 (2Bu)), 1.33 (м, 4H, СН2CH3(2Bu)), 1.46 (м, 4H, 2SСН2СН2 (Bu)), 1.66 (м, 2H, NСН2СН2), 2.04 (м, 2H, CH2 (при С-4)), 2.13 и 2.32 (м, 2Н, CH2 (при С-3)), 2.25 (c, 6H, OMe), 2.47–2.55 (м, 4Н, 2SCH2 (2Bu)), 2.76 (м, 6H, NСН2), 3.43 (т, 2Н, J = 7.4 Гц, =NСН2), 3.71 (м, 6Н, ОСН2), 6.64 (с, 1Н, =СН(О)), 7.48 (с, 1Н, N=CH). 13C ЯМР (CDCl3, 101.6 MГц) δ: 13.66 (SiCH2), 13.73 (СН3 (2Me (Bu)), 21.63 (CH2CH3 (Bu при С*)), 22.08 (CH2CH3 (Bu при C=), 23.4 (OMe), 23.78 (C-3), 26.34 (NСН2СН2), 27.47 (SCH2 (Bu при С*)), 29.81 (С-4), 31.49 (SCH2СН2 (Bu при С*)), 31.78 (SCH2СН2 (Bu при С=)), 32.35 (SCH2 (Bu при С=), 51.16 (NCH2 (сил)), 57.81 (OCH2), 64.15 (NCH2), 84.70 (С*), 107.03 (С-5), 144.03 (=CHO), 160.42 (CH=N), 182.4 (COO).
Найдено, %: С, 47.64; Н, 7.43; N, 4.66. С48Н90N4O12S4Si2Cd.
Вычислено, %: С, 47.60; Н, 7.44; N, 4.63.
Комплекс (7). Зеленый порошок, выход 96%. ИК-спектр, ν, cм–1 1657 (C=N), 1459 (C=C), 1365 (NCH2), 1272 (OCH2), 1051 (Si–O), 764 (SCH2). ЯМР спектры получить не удается из-за парамагнитности атомов меди.
Найдено, %: С, 49.53; Н, 7.72; N, 4.83. С48Н90N4O12S4Si2Cu.
Вычислено, %: С, 49.57; Н, 7.74; N, 4.82.
Осуществлен анализ ИК и 1Н, 13С ЯМР спектров силатрана (3), комплексов (4–7). В ИК-спектре гибридного силатрана (3) проявляется полоса поглощения 769 см–1 сульфидной группы SCH2, а также характерные полосы поглощения силатранильной группы при 1051 см–1 (Si–O), 1276 см–1 (O–CH2), 1365 см–1 (CH2–N). Полосы поглощения в области 1456 см–1 и 1626 см–1 относятся к валентным колебаниям C=C и C=N дигидропиранового кольца и иминной группы, соответственно.
Сравнение полос поглощения 764 см–1 (SCH2), 1651–1662 см–1 (C=N) в спектрах комплексов (4–7) с аналогичными полосами в спектрах силатрана (3) показывает понижение их интенсивности и заметное смещение, что может указывать на образование координационной связи между ионами Cd(II), Cu(II) и атомами азота и серы гибридного силатрана (3).
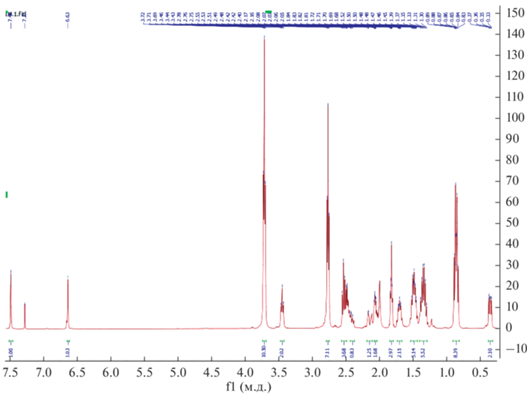
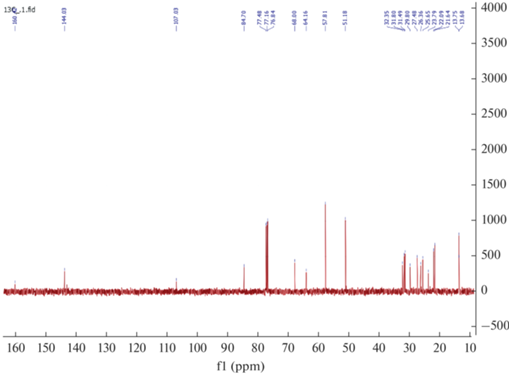
Проведен анализ 1Н, 13C ЯМР спектров силатрана (3) и его комплексов (4–7). В спектрах 1Н ЯМР силатрана (3) присутствуют сигналы протонов группы SCH2, 2.44–2.51 м.д., силатранильной группы 2.73 м.д. (NСН2), 3.66 м.д. (ОСН2), а также иминной группы 7.43 м.д. (CH=N) (рис. 3).
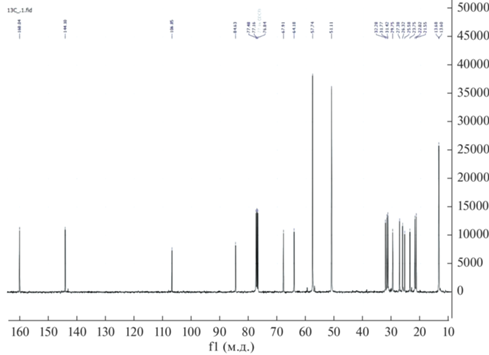
В спектрах 13C ЯМР наблюдаются сигналы углерода группы SCH2 27.38 м.д., сигналы силатранильной группы 51.11 м.д. (NCH2), 57.74 м.д. (OCH2), а также иминной группы 160.04 м.д. (CH=N) (рис. 4).
Проведенный ЯМР-мониторинг взаимодействия гибридного силатрана (3) с постадийным добавлением хлоридов и ацетатов Cd(II) и Cu(II) показал изменения в спектрах ЯМР характерные для комплексообразования по активным центрам SCH2 и CH=N. Например, в спектрах 1Н ЯМР комплекса (4) наблюдается уширение и смещение сигналов SCH2 (2.55 м.д.) и CH=N (7.48 м.д.) групп в слабое поле (рис. 5).
В спектрах 13С ЯМР комплекса (4) уширение и смещение претерпевают сигналы углеродов SCH2 (27.48 м.д.) и CH=N (160.42 м.д.) (рис. 6).
Эти спектральные эффекты свидетельствуют об участии этих групп в координации с металлом.
Таким образом, результаты элементного анализа, а также данные ИК, ЯМР-спектроскопии подтверждает образование комплексов (4–7) состава 2 : 1. Их предполагаемая структура отображена на схеме 3 .
Схема 3 . Предполагаемая структура комплексов (4–7).
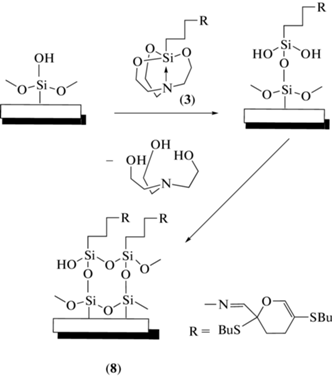
Иммобилизацию силатрана (3) на поверхность специально подготовленного стекла проводили по схеме 2 , подобно методике [14] (см. экспериментальную часть). После процедуры иммобилизации, соответствующей промывки и высушивания получали образцы функционализированного стекла (8).
Модификация поверхности стекла, очевидно, является результатом взаимодействия между силатраном (3) и гидроксильными группами стекла и, вероятно, протекает в несколько стадий:
(a) реакция гидролиза силатрана (3), приводящая к выбросу триэтаноламина и образованию соответствующего силанола (HO)3Si–(CH2)3–R;
(б) реакция конденсации силанола с гидроксильной группой стекла, приводящая к образованию силанольного интермедиата;
(в) реакция конденсации следующей молекулы силанола, как с гидроксильной группой интермедиата, так и с ОН группой стекла, ведущая к образованию цепей –O–Si–O–Si–O–. В результате, не исключается вероятность образования на поверхности стекла самосборных функциональных силоксановых слоев/пленок (схема 2 ).
Схема 2 . Схема получение модифицированного стекла (8).
ИК-спектр функционализированного стекла (8) показал полосы поглощения 770 см–1, соответствующие сульфидной группы SCH2, а также характерные полосы поглощения 1457 и 1628 см–1, которые относятся к валентным колебаниям группы C=C дигидропиранового кольца и иминной группы C=N. Эти данные позволяют предположить, что модификация стекла прошла успешно, а полученные образцы или их аналоги на основе силикагелей, цеолитов, целлюлозы и др. могут быть использованы в качестве сорбентов/гемосорбентов/энтеросорбентов.
Анализ антимикробной активности
Исследования по определению антимикробной активности в отношении к грамположительным (S. aureus), и грамотрицательным (P. aeruginosa, E. coli) бактериям исходного дибутирина (2), гибридного силатрана (3) и комплексных соединений (5, 6), а также поверхности модифицированного стекла (8) проводили на базе ФКУЗ Иркутского научно-исследовательского противочумного института.
Выживаемость микроорганизмов (S. aureus, P. aeruginosa, E.coli) определяли посевом из пробирки с “образец-микроорганизм” при интервалах инкубации (0, 1, 3, 24 и 48 ч) на чашках Петри с питательным агаром. Для оценки роста микроорганизмов использовали метод секторных посевов. Результаты представлены в табл. 2.
Таблица 2.
Антимикробные свойства полученных соединений
| Культура | Время контакта, ч | ||||
|---|---|---|---|---|---|
| 0 | 1 | 3 | 24 | 48 | |
| Дибутирин (2) | |||||
| S. aureus | Рост 106 | Рост 102 | Нет роста | Нет роста | Нет роста |
| P. aeruginosa | Рост 106 | Рост 102 | Нет роста | Нет роста | Нет роста |
| E. coli | Рост 106 | Рост 102 | Нет роста | Нет роста | Нет роста |
| Силатран (3) | |||||
| S. aureus | Рост 106 | Рост 102 | Нет роста | Нет роста | Нет роста |
| P. aeruginosa | Рост 106 | Рост 102 | Нет роста | Нет роста | Нет роста |
| E. coli | Рост 106 | Рост 102 | Нет роста | Нет роста | Нет роста |
| Комплекс (5) | |||||
| S. aureus | Рост 106 | Нет роста | Нет роста | Нет роста | Нет роста |
| P. aeruginosa | Рост 106 | Нет роста | Нет роста | Нет роста | Нет роста |
| E. coli | Рост 106 | Нет роста | Нет роста | Нет роста | Нет роста |
| Комплекс (6) | |||||
| S. aureus | Рост 106 | Нет роста | Нет роста | Нет роста | Нет роста |
| P. aeruginosa | Рост 106 | Нет роста | Нет роста | Нет роста | Нет роста |
| E. coli | Рост 106 | Нет роста | Нет роста | Нет роста | Нет роста |
| Модифицированное стекло (8) | |||||
| S. aureus | Рост 106 | Рост 102 | Нет роста | Нет роста | Нет роста |
| P. aeruginosa | Рост 106 | Рост 102 | Нет роста | Нет роста | Нет роста |
| E. coli | Рост 106 | Рост 102 | Нет роста | Нет роста | Нет роста |
Как видно из табл. 2, дибутирин (2) гибридный силатран (3), а также модифицированное стекло (8) уменьшают рост как грамположительных (золотистый стафилококк), так и грамотрицательных (синегнойная и кишечная палочки) микроорганизмов через 3 ч после контакта.
Комплексные соединения (5) и (6) полностью тормозят рост всех исследованных бактерий уже через 1 ч после контакта и сохраняется в дальнейшем. Эти результаты соответствуют данным о более высокой биологической активности металлокомплексов, по сравнению с лигандами, а также новым стратегиям получения противомикробных материалов [33].
ЗАКЛЮЧЕНИЕ
Таким образом, из доступных реагентов, 1-(3-аминопропил)силатрана (1) и 2,5-дибутилтио-2,3-дигидро-2-формил-4Н-пирана, “дибутирина” (2) синтезирован связанный иминным линкером гибридный силатранил-дигидропирановый каркас (3) и его металлические комплексы с солями Cd(II) и Cu(II) (4–7). На основе гибридного силатрана (3) получены образцы модифицированного стекла (8).
Изучение противомикробных свойств исследуемых соединений (2, 3, 5, 6, 8) показало, что исходный дибутирин (2), синтезированный гибридный силатран (3) и модифицированное стекло (8) при контакте с бактериями Staphylococcus aureus, Pseudomonas aeruginosa и Escherichia coli подавляют рост микроорганизмов одинаково, однако металлические комплексы (5) и (6) останавливают рост бактерий гораздо раньше.
Полученные соединения (3–8) представляют значительный интерес как основа для создания новых комплексообразующих, сорбционных и био-функциональных соединений и материалов.
Основные результаты получены с использованием оборудования Байкальского аналитического центра коллективного пользования СО РАН.
Список литературы
Voronkov M.G., Dyakov V.M., Kirpichenko S.V. // J. Organomet. Chem. 1982. V. 233. P. 1.
Puri J.K., Singh R., Chahal V.K. // Chem. Soc. Rev. 2011. V. 40. P. 1791.
Vlasova N.N., Sorokin M.S., Oborina E.N. // Appl. Organomet. Chem. 2017. V. 31. e3668.https://doi.org/10.1002/aoc.3668
Adamovich S.N. // Appl. Organomet. Chem. 2019. V. 33. e4940.https://doi.org/10.1002/aoc.4940
Adamovich S.N., Kondrashov E.V., Ushakov I.A., Shatokhina N.S., Oborina E.N., Vashchenko A.V., Belovezhets L.A., Rozentsveig I.B., Verpoort F. // Appl. Organomet. Chem. 2020. V. 34. e5976. https://doi.org/10.1002/aoc.5976
Voronkov M.G., Baryshok V.P. // Silatranes in Medicine and Agriculture, SO RAN Publ. Novosibirsk. 2005. C. 255.
Singh G., Saroa A., Girdhar S., Rani S., Choquesillo-Lazarte D., Sahoo S.C. // Appl. Organometal. Chem. 2015. V. 29. P. 549.
Singh G., Arora A., Rani S., Kalra P., Aulakh D., Wried M. // Appl. Organometal. Chem. 2017. V. 31. e3728. https://doi.org/10.1002/aoc.3728
Singh G., Satija P., Singh A., Aulakh D., Wriedt M., Ruiz C.E., Esteban M. ., Sinha S., Sehgal R. // Appl. Organometal. Chem. 2019. V. 33. e4695.https://doi.org/10.1002/aoc.4695
Han A., Li L., Qing K., Qi X., Hou L., Luo X., Shi S., Ye F. // Bioorg. Med. Chem. Lett. 2013. V. 23. P. 1310.
Voronkov M.G., Baryshok V.P. // Pharm. Chem. J. 2004. V. 38. P. 3.
Faqing Ye, Xiaoqin Song, JianminLiu Liu, Xu Xuemei, Wang Yuewu, Hu Lichuan, Wang Yi, Liang Guang, Guo Ping, Xie Zixin // Chem. Biol. Drug. Des. 2015. V. 86. P. 905.
Z.-xin Xie, L.-fang Chen, Y.-wu Wang, X.-qing Song, X.-lu Qi, P. Guo, Fa-q. Ye // Phytochem. Lett. 2014. V. 8. P. 202.
Chen W.-H, Tseng Y.-T., Hsieh S., Liu W.-C., Hsieh C.-W., Wu C.-W., Huang C.-H., Lin H.-Y., Chen C.-W., Linb P.-Y., Chau L.-K. // RSC Adv. 2014. V. 4. P. 46527.
Materna K.L., Brennan B.J., Brudvig G.W. // Dalton Trans. 2015. V. 44. P. 20312.
Tseng Y.-T., Lu H.-Y., Li J.-R., Tung W.-J., Chen W.-H., Chau L.-K. // ACS Appl. Mater. Interfaces. 2016. V. 49. P. 34159.
Singh H., Singh R., Kaur V. // Cellulose. 2019. V. 26. P. 2885.
Huang C.-J., Zheng Y.-Y. // Langmuir. 2019. V. 35. P. 1662.
Dobbs A.P., Martinovi S. // Tetrahedron Lett. 2002. V. 43. P. 7055.
Saha P., Ghosh P., Sultana S., Saikia A. K. // Org. Biomol. Chem. 2012. V. 10. P. 8730.
Баркова Н.П., Кейко Н.А., Степанова Л.Г., Воронков М.Г., Портяной А.А., Никифорова Т.И. // Патент РФ 1727243. Бюлл. Изобрет. 1993. С. 33.
Кейко Н.А., Степанова Л.Г., Чувашов Ю.А., Воронков М.Г. // Патент РФ 2030412. Бюлл. Изобрет. 1995. С. 35.
Кейко Н.А., Вдовина Г.П., Коростелева Л.К., Одегова Т.Ф., Cтепанова Л.Г. // II Конференция “Фундаментальная наука в интересах развития химической и химико-фармацевтической промышленности”. Сборник тезисов докладов. 2004. С. 8.
Viegas C., Jr., Danuello A., Bolzani V. da Silva, Barreiro E.J., Fraga C.A.M. // Curr. Med. Chem. 2007. V. 14. P. 1829.
Corson T.W., Aberle N., Crew C.M. // ACS Chem. Biol. 2008. V. 3. P. 677.
M. de Oliveira Pedrosa, R.M.D. da Cruz, J. de Oliveira Viana, R.O. de Moura, H.M. Ishiki, J.M.B. Filho, M.F.F.M. Diniz, M.T. Scotti, L. Scotti, F.J.B. Mendonca // Curr. Top. Med. Chem. 2017. V. 17. P. 1044.
Dumitriu A.-M.-C., Cazacu M., Shova S., Turta C., Simionescu B. C. // Polyhedron. 2012. V. 33. P. 119.
Singh R., Mutneja R., Kaur V., Wagler J., Kroke E. // J. Organometal. Chem. 2013. V. 724. P. 186.
Ispir E., Kurtoglu M., Purtas F. // Transition Metal Chem. 2005. V. 30. P. 1042.
Гордон А., Форд Р. Спутник химика. М.: Мир. 1976. 541 с.
Покровский В.И. Медицинская микробиология / под ред. Покровского В.И. М.: ГЭОТАР Медицина, 1998. С. 326.
Пьянова Л.Г., Лавренов A.В., Kорниенко Н.В., Огурцова Д.Н. // Физикохимия поверхностей и зашита материалов. 2020. Т. 56. С. 595.
Claudel M., Schwarte J.V., Fromm K.M. // Chemistry. 2020. V. 2. P. 849. https://doi.org/10.3390/chemistry2040056
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов