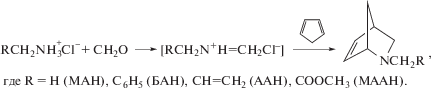Высокомолекулярные соединения (серия Б), 2020, T. 62, № 1, стр. 35-43
РАДИКАЛЬНАЯ СОПОЛИМЕРИЗАЦИЯ N-ЗАМЕЩЕННЫХ
М. Н. Горбунова a, *, И. А. Борисова a
a Институт технической химии Уральского отделения Российской академии наук
614013 Пермь, ул. Королева, 3, Россия
* E-mail: mngorb@yandex.ru
Поступила в редакцию 07.06.2019
После доработки 19.07.2019
Принята к публикации 30.08.2019
Аннотация
Изучена радикальная сополимеризация N-метил-2-азанорборнена-5, N-бензил-2-азанорборнена-5, N-аллил-2-азанорборнена-5 и N-(2-азанорборнен-5-ен)метилацетата с N-винилпирролидоном в массе в присутствии инициатора ДАК. Показано, что сополимеризация протекает с образованием статистических сополимеров, обогащенных звеньями N-винилпирролидона. Выяснено, что скорость реакции сополимеризации понижается с увеличением доли азанорборнена в исходной мономерной смеси. Методом спектроскопии ЯМР 13С установлено, что сополимеризация азанорборненов с N-винилпирролидоном протекает по двойной связи норборненового кольца. Аллильная группа N-аллил-2-азанорборнена-5 не участвует в сополимеризации как при эквимольном соотношении мономеров, так и при двойном избытке N-винилпирролидона.
2-Азабицикло[2.2.1]гептаны и 2-азабицикло[2.2.1]гептены представляют большой интерес в качестве эффективных лекарственных препаратов или биологически активных агентов [1–9]. Производные этих препаратов проявляют высокую селективную активность к различным подвидам никотиновых ацетилхолиновых рецепторов [4, 5, 7], их используют в производстве карбоциклических нуклеозидов, применяемых в качестве антивирусных препаратов [1, 6], для синтеза аналогов алкалоида эпибатидина [3, 8, 9]. На основе 2-азанорборненового каркаса синтезируют бициклические аналоги аминокислот для исследования структуры белка [10, 11]. Производные 2-азанорборнена также используют для синтеза хиральных пятичленных циклических структур, выступающих потенциальными биомиметиками [12].
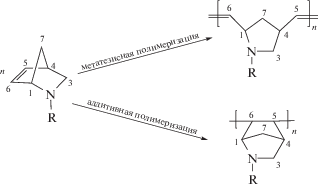
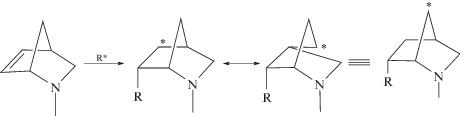
Азанорборнены, являющиеся напряженными олефинами, могут полимеризоваться как с раскрытием цикла – метатезисная полимеризация, так и с раскрытием связи С=С с образованием насыщенных структур – аддитивная полимеризация:
Основная часть публикаций посвящена метатезисной полимеризации азанорборненов [13–15]. Однако полимеризация азанорборненов с раскрытием связи С=С с образованием бициклических звеньев в основной цепи привлекает внимание в плане создания нового класса карбоцепных полимеров.
Ранее демонстрировалось [16], что в реакцию гомополимеризации в присутствии радикальных инициаторов (ДАК, перекись бензоила) синтезированные азанорборнены практически не вступают. В работе [17] показана принципиальная возможность синтеза сополимера N-аллил-2-азанорборнена-5 с N-винилпирролидоном.
В последнее время в связи с широким применением N-винилпирролидона в медицине и биотехнологии исследования в области его использования вызывают интерес. Данных о радикальной сополимеризации N-метил-2-азанорборнена-5, N-бензил-2-азанорборнена-5 и N-(2-азанорборнен-5-ен)метилацетата с N-винилпирролидоном в литературе не имеется. Поэтому целью настоящей работы явилось изучение радикальной сополимеризации указанных азанорборненов с винилпирролидоном, исследование состава, структуры и свойств получаемых сополимеров.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Азанорборнены получали по методике, описанной в работе [18]. Для полимеризации использовали следующие фракции: N-метил-2-азанорборнена-5 (МАН) – температура кипения Ткип = = 40–41 град/15 мм рт.ст., $n_{{\text{D}}}^{{25}}$ = 1.4726; N-бензил-2-азанорборнена-5 (БАН) – Ткип = 99–102 град/0.5 мм рт.ст., $n_{{\text{D}}}^{{20}}$ = 1.5489; N-аллил-2-азанорборнена-5 (ААН) – Ткип = 51–53 град/1 мм рт.ст., $n_{{\text{D}}}^{{20}}$ = = 1.4880; N-(2-азанорборнен-5-ен)метилацетата (МААН) – Ткип = 80–82 град/ 1.5 мм рт.ст., $n_{{\text{D}}}^{{20}}$ = = 1.4830. Чистоту контролировали элементным анализом и методом спектроскопии ЯМР 13С. Основные спектральные характеристики азанорборненов приведены в табл. 1.
Таблица 1.
Основные спектральные характеристики азанорборненов
| Структура | Спектр ЯМР 1Н: δН, м.д. (J/Гц) | Спектр ЯМР 13С: δС, м.д. | Основные пики ИК-спектра, υ (см–1) |
|---|---|---|---|
МАН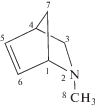 |
1.23 (H3-эндо, dd, J1 = 2.8, J2 =8.2); 1.26 (Н7-син, d, J = 8); 1.44 (Н7-анти, d, J = 8); 2.06 (H8, s); 2.85 (H4, s); 3.03 (H3-экзо, dd, J1 = 2.8, J2 = 8); 3.65 (Н1, d, J = 0.8); 6.01 (H5, dd, J1 = 2, J2 = 5.7); 6.32 (H6, dd, J1 = 2.8, J2 = 6.3) | 40.76 С8; 43.81 С4; 47.96 С7; 53.05 С3; 65.34 С1; 130.3 С5; 135.6 С6 | 1647 (С=С) 1202 (С–N) |
БАН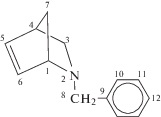 |
1.33 (Н7-син, d , J = 8); 1.44 (H3-эндо, dd, J1 = 1.8, J2 = 9); 1.56 (Н7-анти, d, J = 8); 2.84 (H4, s); 3.09 (H3-экзо, dd, J1 = 2.8, J2 = 8); 3.25 (H8, d, J = 13.2); 3.49 (H8, d, J = 13.2); 3.79 (Н1, d, J = 0.8); 6.0 (H5, dd, J1 = 2.1, J2 = 5.7); 6.29 (H6, dd, J1 = 3.3, J2 = 5.7); 7.12–7.28 (H9-12, m) | 43.21 С4; 46.43 С7; 53.01 С3; 60.03 С8; 65.20 С1; 126.2 С12; 129.1 С10; 130.1 С11; 130.2 С5; 135.3 С6; 139.7 С9 | 1603 (C=C) 1560 (Ar) 1186 (C–N) |
ААН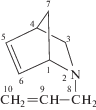 |
1.4 (Н7-син, dd, J1 = 1.6, J2 = 8); 1.46 (H3-эндо, dd, J1 = 1.8, J2 = 8.4); 1.59 (Н7-анти, d, J = 8); 2.78 (H8, d, J = 13.2); 2.89 (H4, s); 3.02 (H8, d, J = 13.2); 3.13 (H3-экзо, dd, J1 = 2.8, J2 = 8); 3.86 (Н1, m); 5.04 (H10-цис, dd, J1 = 1.2, J2 = 10); 5.11 (H10-транс, dd, J1 = 2, J2= 16); 5.90 (H9, m); 5.99 (H5, dd, J1 = 2.1, J2 = 5.7); 6.30 (H6, dd, J1 = 3, J2 = 5.4) | 43.41 С4; 47.42 С7; 52.10 С3; 57.06 С8; 64.12 С1; 116.2 С10; 130.6 С5; 136.1 С6; 136.2 С9 | 1642 (C=C) 1195 (C–N) |
МААН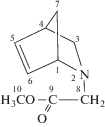 |
1.27 (Н7-син, d, J = 2); 1.39 (Н7-анти, d, J = 2.1); 1.46 (H3-эндо, d, J = 2.1); 2.83 (H8, d, J = 16); 2.89 (H4, s); 3.15 (H3-экзо, dd, J1 = 4.9, J2 = 10.5); 3.31 (H8, d, J = 16); 3.59 (H10, s); 3.85 (Н1, s); 6.01 (H5, dd, J1 = 1.6, J2 = 6.7); 6.33 (H6, d, J = 4); | 43.40 С4; 47.39 С7; 50.65 С10; 52.62 С8; 55.83 С3; 64.18 С1; 130.2 С5; 136.2 С6; 171.1 С9 | 1753 (C=O) 1647 (C=C) 1203 (C–N) |
Винилпирролидон фирмы “Lancaster” квалификации х.ч. сушили над КОН и очищали перегонкой в вакууме. Для сополимеризации использовали фракцию с температурой кипения 65 град/1.5 мм рт.ст., $d_{4}^{{20}}$ = 1.0450, $n_{{\text{D}}}^{{20}}$ = 1.5117.
ДАК трижды перекристаллизовывали из метанола, сушили в вакууме при комнатной температуре до постоянной массы, температура плавления Тпл составляла 103°С, с разложением.
Растворители и другие стандартные реактивы после очистки общепринятыми методами [19] по своим характеристикам соответствовали литературным данным.
Сополимеризацию азанорборненов с винилпирролидоном осуществляли в массе в вакууме в присутствии ДАК. Кинетику процесса изучали гравиметрическим методом [20]. При достижении нужной степени конверсии полимеризацию прерывали охлаждением и последующим осаждением диэтиловым эфиром. Осажденный сополимер отделяли из смеси центрифугированием. Скорость V0 рассчитывали по начальным участкам кинетических кривых до степени конверсии ≤10%.
Сополимеры очищали двукратным переосаждением в диэтиловый эфир из раствора в метаноле и сушили в вакууме при 40–50°С до постоянной массы. Состав сополимеров рассчитывали по результатам элементного анализа. В случае сополимеров МАН с винилпирролидоном в связи с одинаковым содержанием азота в мономерах состав сополимера определяли методом ЯМР-спектроскопии.
Элементный анализ выполняли на элементном анализаторе Leco CHNS-9321P (Нидерланды). Навеска образца составляла 2 мг, коэффициент вариации значений находился в диапазоне от 0.05 до 0.29%.
Эффективные константы сополимеризации r1 и r2 рассчитывали методами Майо–Льюиса, Файнемана–Росса и Келена–Тюдеша [21–23]. Характеристическую вязкость [η] (дл/г) определяли с помощью вискозиметра Уббелоде. Молекулярную массу сополимеров, содержащих 10 мол. % азанорборнена, оценивали по уравнению Леви и Франка для поливинилпирролидона ([η] = = 6.76 M0.55 × 10–4) [24].
ИК-спектры сополимеров регистрировали на спектрометре “IFS 66/S Bruker” в виде пленок из хлороформа. Спектры ЯМР 1Н и ЯМР 13С регистрировали на спектрометре “Bruker AM-400” (рабочая частота 400 и 100 МГц соответственно) с широкополосным подавлением по протонам и в режиме “моно-резонанса”. В качестве растворителя использовали CDCl3 и ДМСО-d6; внутренним стандартом служил тетраметилсилан.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
N-замещенные 2-азанорборнены-5 были синтезированы по реакции Дильса–Альдера:
Реакция легко протекает в водной гетерофазной среде. Показано, что основное влияние на протекание реакции оказывает природа амина в структуре имина. При переходе от метиламингидрохлорида к бензиламингидрохлориду выход соответствующего азанорборнена возрастает: выходы для МАН, МААН, ААН и БАН составляют 55, 71, 74 и 83% соответственно.
Ранее отмечено, что указанные азанорборнены практически не гомополимеризуются [16]. Так, в присутствии ДАК в количестве 2.5% выход гомополимера БАН за 10 ч при температуре 80°С не превышает 0.5%. Более активны азанорборнены в реакциях сополимеризации с виниловыми мономерами, однако их активность в реакциях радикальной сополимеризации достаточно низкая. В частности, при сополимеризации ААН и БАН с акрилонитрилом, метилметакрилатом, стиролом при эквимольном соотношении мономеров в исходной смеси содержание азанорборнена в макроцепи составляет ~10–15 и 10–25 мол. % соответственно. Высокая активность БАН наблюдается при его сополимеризации с винилацетатом: при эквимольном соотношении мономеров в исходной смеси содержание БАН в сополимере составляет ~70 мол. %.
В настоящей работе сополимеры азанорборненов с винилпирролидоном были получены методом радикальной сополимеризации в массе в присутствии инициатора ДАК. Зависимость состава сополимеров от состава исходных смесей приведена на рис. 1. Видно, что при сополимеризации азанорборненов с винилпирролидоном образующиеся продукты имеют статистическое распределение сомономерных звеньев в макромолекуле. Значения эффективных констант сополимеризации свидетельствуют (табл. 2), что винилпирролидон характеризуется более высокой реакционной способностью и присоединяется предпочтительно к “собственному” радикалу, в то время как азанорборнены легче присоединяются к “чужому” радикалу растущей полимерной цепи. В результате, при всех исходных соотношениях сомономеров образующиеся сополимеры обогащены звеньями более активного винилпирролидона. Полученные данные свидетельствуют также, что активность азанорборненов в большой степени зависит от природы заместителя у N-атома. Реакционная активность азанорборненов по отношению к радикалу винилпирролидона повышается в ряду ААН < БАН ≤ МАН < МААН.
Рис. 1.
Зависимость состава сополимеров МАН (1), БАН (2), ААН (3) и МААН (4) с винилпирролидоном от состава исходной смеси мономеров при полимеризации в массе; M2 и m2 – мольные доли винилпирролидона в исходной смеси и в сополимере соответственно. [ДАК] = 3 мас. %, T = 80°C.
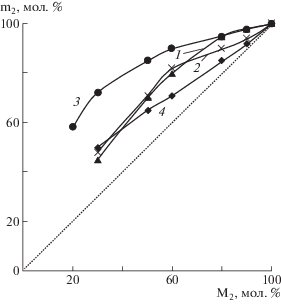
Таблица 2.
Значения эффективных констант эффективной энергии активации сополимеризации азанорборненов с винилпирролидоном (М) (ДАК, Т = 80°С)
| М | r1 | r2 | 1/r2 | r1r2 | Е*а, кДж/моль |
|---|---|---|---|---|---|
| ААН | 0.1 ± 0.01 | 4.5 ± 0.40 | 0.22 | 0.45 | 84.8 ± 1.5 |
| БАН | 0.2 ± 0.02 | 2.2 ± 0.13 | 0.45 | 0.44 | 77. 9 ± 1.0 |
| МАН | 0.3 ± 0.09 | 2.1 ± 0.11 | 0.48 | 0.63 | 75.7 ± 1.1 |
| МААН | 0.2 ± 0.01 | 1.5 ± 0.25 | 0.67 | 0.30 | 88.4 ± 1.9 |
Анализ кинетических закономерностей сополимеризации азанорборненов с винилпирролидоном в области малых значений конверсии (менее 10%) показал, что при увеличении содержания азанорборненов в исходной мономерной смеси показатели скорости сополимеризации всех систем значительно снижаются (рис. 2). Наибольшая скорость сополимеризации наблюдается для системы МАН–винилпирролидон, и далее снижается в ряду БАН > ААН > МААН.
Рис. 2.
Зависимость начальной скорости сополимеризации МАН (1), БАН (2), ААН (3) и МААН (4) с винилпирролидоном от состава исходной смеси мономеров. [ДАК] = 3 мас. %, Т = 80°С.
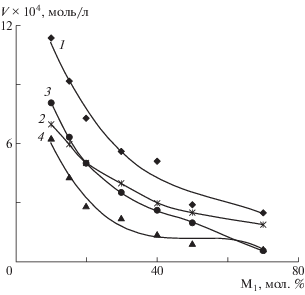
При сополимеризации винилпирролидона со всеми изученными азанорборненами соблюдаются обычные для радикальной сополимеризации половинные порядки реакций по инициатору, что свидетельствует о бимолекулярном механизме обрыва растущих цепей. Порядки реакций по сумме мономеров (при их эквимольном соотношении) для систем винилпирролидона с МАН, БАН, ААН и МААН равны 1.1, 1.2, 1.3 и 1.2 соответственно.
Температурную зависимость скорости реакции азанорборненов с винилпирролидоном исследовали в интервале температуры 70–90°С при соотношении мономеров [АНБ] : [ВП] = 20 : 80. Значения эффективной энергии активации Еа, вычисленные по уравнению Аррениуса (табл. 2), лежат в области, свойственной для радикальной полимеризации.
Сополимеризация азанорборненов с винилпирролидоном продолжается до глубоких степеней превращения. Предельная конверсия для изученных мономерных пар зависит от содержания азанорборненов в исходной мономерной смеси. Так, при содержании МАН 22 мол. % в исходной мономерной смеси реакция протекает до степеней превращения 75% за 3.5 ч; при содержании МАН 68 мол. % в исходной смеси при проведении реакции в течение 450 мин выход не превышает 50%.
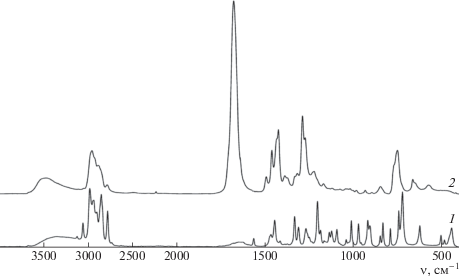
ИК-спектры МАН и его сополимера с винилпирролидоном представлены на рис. 3. В спектре сополимера присутствует сильная полоса в области 1677 см–1, характерная для карбонильной группы винилпирролидона, и триплет при 1423, 1460 и 1492 см–1, относящийся к колебаниям метиленовых групп. Отсутствие полос в области 1500–1670 см–1 однозначно свидетельствует об отсутствии двойных связей в сополимере.
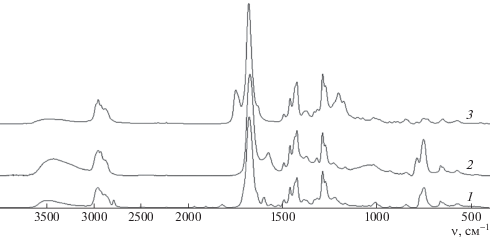
На рис. 4 показаны спектры БАН, ААН и МААН с винилпирролидоном. В ИК-спектре сополимера БАН с винилпирролидоном (спектр 1) присутствует полоса в области 1600 см–1, характерная для колебаний двойных связей бензольного кольца, а в спектре сополимера ААН с винилпирролидоном (спектр 2) можно наблюдать полосу 1576 см–1, относящуюся к колебаниям аллильной группы. В ИК-спектре сополимера МААН с винилпирролидоном (спектр 3) проявляется сильная полоса 1748 см–1, характерная для карбонильной группы звена МААН, при этом также отсутствуют полосы поглощения в области 1500–1670 см–1. В спектрах всех сополимеров азанорборненов с винилпирролидоном можно видеть сильную полосу поглощения карбонильной группы винилпирролидона в области 1677 см–1 и триплет при 1424, 1460 и 1492 см–1, относящийся к колебаниям метиленовых групп. Исходя из полученных данных, можно заключить, что при сополимеризации азанорборненов с винилпирролидоном образуются насыщенные сополимеры.
Рис. 4.
ИК-спектры сополимеров БАН–винилпирролидон (1), ААН–винилпирролидон (2) и МААН–винилпирролидон (3) (пленка из хлороформа).
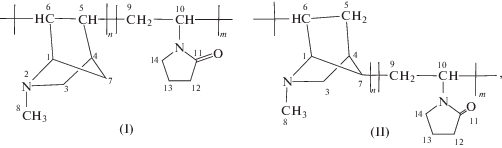
При сополимеризации может происходить раскрытие двойной связи С=С азанорборненов с образованием структуры (I), но теоретически также возможно появление насыщенной структуры (II):
которая была получена перегруппировкой норборненового радикала:
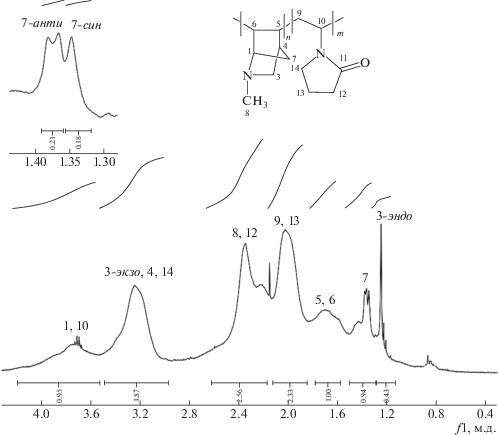
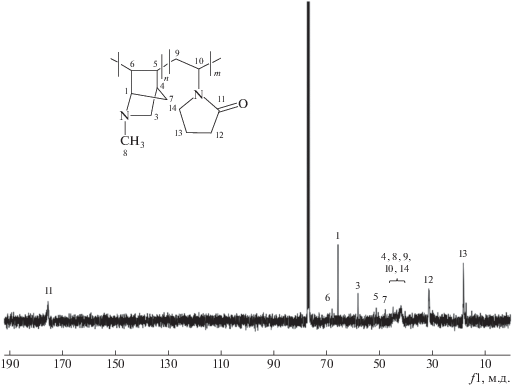
Обзорныe спектры ЯМР 1Н и ЯМР 13С сополимера МАН с винилпирролидоном представлены на рис. 5 и 6. Видно, что спектры сополимера МАН–винилпирролидон также не содержат сигналов атомов ненасыщенных связей, т.е. сополимеризация протекает исключительно с раскрытием связей С=С азанорборнена.
Следует отметить сложный характер ЯМР-спектров сополимеров азанорборненов, что свидетельствует о присутствии разнообразных конформаций цепей синтезированных полимеров. При определении структуры сополимеров химические сдвиги атомов углерода были установлены с использованием спектральных литературных данных для замещенных бициклических соединений [25], а также для норборнана и димеров норборнена [26, 27]. Аддитивное влияние винилпирролидонового звена тоже было принято во внимание.
В спектре ЯМР 1Н сополимера МАН с винилпирролидоном в области 1.3–1.5 м.д. присутствуют сигналы двух мостиковых протонов Н7-син и Н7-анти (вставка на рис. 5), что подтверждает образование в результате реакции сополимеризации 5–6 звеньев при раскрытии двойной связи МАН.
Значения химических сдвигов углеродных атомов сополимеров БАН, ААН, МААН с винилпирролидоном представлены в табл. 3. Видно, что значения хим. сдвигов атомов углерода кольца винилпирролидона в сополимере близки к величинам хим. сдвигов соответствующих углеродных атомов в молекуле мономерного винилпирролидона. В спектрах ЯМР 13С сополимеров имеются сигналы, соответствующие атомам бензольного кольца БАН (127.1–137.7 м.д.), аллильной группы ААН (59.71, 116.1, 136.9 м.д.) и метоксикарбонильной группы МААН (51.0, 171.1 м.д.). Анализ значений хим. сдвигов сигналов свидетельствует, что полученные продукты содержат до 70% сополимеров и около 20% экзо- и эндо-стереоизомерных димеров.
Таблица 3.
Значения химических сдвигов сигналов на спектрах ЯМР 13С сополимеров БАН, ААН, МААН с винилпирролидоном
| Структура | Хим. сдвиги (δ, м.д.) для атомов |
|---|---|
БАН–винилпирролидон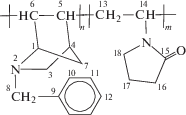 |
18.66 С17; 30.05 С16; 30.17 С13; 42.44 С18; 45.34 С14; 45.65 С7; 45.77 С4; 54.33 С3; 55.07 С5; 59.97 С8; 64.38 С1; 65.88 С6; 127.1 С12; 128.6 С10; 129.5 С11; 137.7 С9; 172.8 С15 |
ААН–винилпирролидон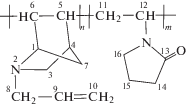 |
18.02 С15; 30.80 С11; 30.99 С14; 43.41 С12; 44.15 С4; 44.71 С16; 47.62 С7; 52.02 С3; 57.41 С5; 59.71 С8; 64.12 С1; 66.13 С6; 116.1 С10; 136.9 С9; 173.7 С13 |
МААН–винилпирролидон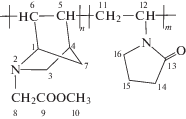 |
18.53 С15; 29.53 С14; 30.50 С11; 40.32 С12; 43.30 С7; 44.98 С16; 47.71 С4; 51.0 С10; 53.3 С5; 55.62 С3; 61.0 С8; 62.03 С6; 64.62 С1; 171.1 С9; 174.4 С13 |
Двойная связь аллильной группы ААН не участвует в сополимеризации с винилпирролидоном при всех составах исходной мономерной смеси. Такие результаты согласуются с полученными ранее данными по сополимеризации азанорборненов с SO2 [16].
Сополимеры винилпирролидона с азанорборненами растворимы в воде, метаноле, хлороформе, ДМСО, ДМФА и не растворимы в диэтиловом эфире, гексане, бензоле. Значения характеристической вязкости сополимеров азанорборненов с винилпирролидоном (состава 10 : 90 мол. %) и молекулярные массы сополимеров, рассчитанные по уравнению Леви и Франка для поливинилпирролидона ([η] = 6.76 M0.55 × 10–4 [24]), представлены в табл. 4.
Таблица 4.
Значения характеристической вязкости растворов сополимеров АНБ с ВП в воде ([АНБ]/[ВП] = = 10/90, ДАК, 80°С) и ММ сополимеров, оцененные по уравнению Леви и Франка [21]
| Азанорборнены | η, дл/г | М × 10–3 |
|---|---|---|
| МАН | 0.09 | 7.3 |
| БАН | 0.15 | 18.44 |
| ААН | 0.11 | 10.49 |
| МААН | 0.13 | 14.2 |
Таким образом, методом радикальной сополимеризации впервые получены новые водорастворимые сополимеры N-замещенных 2-азанорборненов-5 с N-винилпирролидоном. Установлено, что сополимеризация азанорборненов с N-винилпирролидоном протекает по двойной связи норборненового кольца. Сополимеры N-замещенных 2-азанорборненов-5 с N-винилпирролидоном растворимы в воде и являются перспективным для разработки новых водорастворимых материалов медицинского назначения.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (код проекта 19-43-590019-р_урал-а).
Список литературы
Ishikura Minoru, Murakami Atsushi, Katagiri Nobuya // Heterocycles. 2002. V. 58. P. 317.
Mitch C.H., Quimby S.J. Pat. 6559171 USA. // PЖXим. 2003. № 23. 19O.161П.
Hodgson D.M., Maxwell C.R., Wisedale R., Matthews I.R., Carpenter K.J., Dickenson A.H., Wonnacott S. // J. Chem. Soc. Perkin Trans. 1. 2001. № 23. P. 3150.
Cox Caroline D., Malpass John R., Gordon J., Rosen A. // J. Chem. Soc. Perkin Trans. 1. 2001. № 19. P. 2372.
Schiemann K., Leibrock J. Pat. 10044905 DE. // PЖXим. 2002. № 22. 19O.57П.
Fukumoto T., Ikarashi R. Pat. 1048650 EP. // PЖXим. 2001. № 7. 19H.136П.
Perrin V., Riveron V. , Balme G., Gore J. // J. Chem. Res. Synop. 2000. № 2. P. 60.
Hadgson D.M., Maxwell C.R., Matthews I.R. // Synlett. 1998. № 12. P. 1349.
Malpass John.R., Cox Caroline D. // Tetrahedron Lett. 1999. V. 40. № 7. P. 1419.
Sunden H., Ibrahem I., Eriksson L., Cordova A. // Angew. Chem. Int. Ed. 2005. V. 44. P. 4877.
Ruggiu A.A., Lysek R., Moreno-Clavijo E., Moreno-Vargas A.J., Robina I., Vogel P. // Tetrahedron. 2010. V. 66. P. 7309.
Wojaczyńska E., Wojaczyński J., Kleniewska K., Dorsz M., Olszewski T.K. // Org. Biomol. Chem. 2015. V. 13. P. 6116.
Dragutan V., Streck R. Catalytic Polymerization of Cycloolefins: Ionic, Ziegler-Natta and Ring-Opening Metathesis Polymerization. Amsterdam: Elsevier, 2000.
Berger G., Fusaro L., Luhmer M., der Lee A., Crousse B., Meyer F. // Tetrahedron Lett. 2014. V. 55. P. 6339.
Rossegger E., Oláh L., Fischer R., Kaschnitz P., Varga O., Kállay M., Scheipl G., Stelzer F., Wiesbrock F. // Polym. Chem. 2012. V. 3. P. 2760.
Воробьева А.И., Горбунова М.Н., Сурков В.Д., Муслухов Р.Р., Сатаева Ф.А., Колесов С.В., Толстиков А.Г., Монаков Ю.Б. // Журн. прикл. химии. 2007. Т. 80. № 10. С. 1683.
Горбунова М.Н. // Журн. прикл. химии. 2010. Т. 83. № 8. С. 1324.
Larsen S.D., Grieco P.A. // J. Am. Chem. Soc. 1985. V. 107. P. 1768.
Гордон А., Форд Р. Спутник химика. М.: Мир, 1976.
Торопцева А.М., Белогорская К.В., Бондаренко В.М. Лабораторный практикум по химии и технологии высокомолекулярных соединений. Л.: Химия, 1972.
Mayo F.R., Lewis F.J. // J. Am. Chem. Soc. 1944. V. 66. P. 1594.
Finemann M., Ross S.D. // J. Polym. Sci. 1950. V. 5. P. 269.
Kelen T., Tüdős F. // J. Macromol. Sci., Chem. 1975. V. 9. № 1. P. 27.
Levy G.B., Frank H.P. // J. Polym. Sci. 1955. V. 17. № 84. P. 247.
Clerk P., Simon S. Spectral Data for Structure Determination of Organic Compounds. Berlin: Springer-Verlag, 1983. P. 380.
Olah G.A., White A.M., DeMember J.R., Commeyras A., Liu C.Y. // J. Am. Chem. Soc. 1970. V. 92. P. 4627.
Arnold D.R., Trecker D.J., Whipple E.B. // J. Am. Chem. Soc. 1965. V. 87. P. 2596.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия Б)