Химия высоких энергий, 2023, T. 57, № 2, стр. 139-143
Деградация хромофорных функций красителей в облучаемых растворах
Е. М. Холодкова a, А. В. Пономарев a, *
a Институт физической химии и электрохимии им. А.Н. Фрумкина
Российской Академии наук
119071 Москва, Ленинский просп., 31, стр. 4, Россия
* E-mail: ponomarev@ipc.rssi.ru
Поступила в редакцию 10.11.2022
После доработки 10.11.2022
Принята к публикации 11.11.2022
- EDN: NGVDBL
- DOI: 10.31857/S0023119323020079
Аннотация
Радиолиз повреждает систему сопряженных связей и, тем самым, приводит к деградации хромофорных функций красителей в водных растворах. Для 10 представителей хинофталоновых, индигоидных, трифенилметановых и азокрасителей наблюдается однотипная корреляция между поглощенной дозой и степенью обесцвечивания. Методом конкурирующих акцепторов показано, что в аэрированных растворах окраска снижается главным образом вследствие присоединения радикалов ОН к красителю. Радиационно-химические выходы обесцвечивания составляют от 0.03 до 0.11 мкмоль/Дж, увеличиваясь в зависимости от длины сопряжения связей в молекуле красителя. Для практического электронно-лучевого обесцвечивания растворов 20 мг/дм3 красителей достаточно поглощенной дозы 1–1.5 кГр.
ВВЕДЕНИЕ
Разнообразие химических веществ, попадающих в коммунальные и промышленные сточные воды, неуклонно расширяется, в частности, за счет синтетических органических соединений с сопряженными связями. Сопряженные системы присущи ароматическим углеводородам, алкадиенам, карбоновым кислотам, мочевине и им подобным. Они могут содержать гетероатомы (галогены, N, S) или обладать способностью к ассоциации с гетероатомными соединениями. Сопряжение, состоящее в делокализации p-электронной плотности, обеспечивает таким молекулам повышенную термодинамическую устойчивость по сравнению с соединениями, содержащими изолированные двойные связи [1]. Чем длиннее сопряжение, тем выше термодинамическая устойчивость соединения, что усложняет очистку стоков. Типичными представителями стойких сопряженных систем в сточной воде являются органические красители. В последнее время все больше красителей приобретает статус “пищевых добавок”, что создает в обществе иллюзию об их безвредности [2, 3]. Вместе с тем, стойкость красителя служит основным критерием его применения в различных сферах. Оборотная сторона стойкости заключается в сложности разложения большинства красителей традиционными методами водоочистки. Как следствие, попадая с плохо-очищенными сточными водами в водоемы, красители ухудшают их прозрачность и, тем самым, ослабляют фотосинтез (естественное восполнение кислорода) [3, 4].
Радиолиз принадлежит к числу Передовых Окислительных Процессов (АОР), способных обезвреживать различные органические загрязнители с сопряженными связями, включая красители [5–7]. В настоящей работе исследовано влияние ионизирующего излучения на 10 соединений, представляющих четыре группы универсальных красителей (хинофталон Е104; индиго Е132; трифенилметаны: Е133 и Е142; азо: Е102, Е122, Е124, Е129, Е151 и Е155), различающихся как длиной системы сопряжения внутримолекулярных связей, так и типом хромофора. В азокрасителях основные хромофорные функции выполняют одна или несколько азогрупп –N=N–, соединяющих ароматические звенья. В трифенилметановых красителях функцию хромофора выполняет хиноидное звено, образованное введением амино- или гидроксигруппы в пара-положение к центральному углероду метана. Хромофорная система индигоидных красителей состоит из производных индола или бензотиофена и характеризуется наличием интраионизированной системы сопряжения с электронодонорными и электроноакцепторными заместителями на концах. Система сопряжения хинофталонового красителя образована индандионовыми и хинолиновыми звеньями.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использовали синтетические красители от ABF (США), Kerry Ingredients Flavors (Ирландия) и Top Product (Россия). Растворы содержали 0.02 г/дм3 красителя в дистиллированной воде. Селективным акцептором ОН радикалов служил трет-бутанол (0.5 моль/дм3). Акцептором электронов служила хлорная кислота (HClO4; 1 ммоль/дм3). Источником излучения служил линейный ускоритель LINS-03-350-EURF (США) с энергией электронного пучка 3 МэВ и частотой повторения импульсов 25 Гц (импульсы: 4 мкс; 0.88 Гр/импульс). Растворы облучали при 20 ± ± 2°С в стеклянных пробирках с внутренним диаметром 13 мм до дозы 1–1.5 кГр. Дозиметром служил сополимер с феназиновым красителем СО ПД(Ф)Р-5/50 (ГСО 7865-2000). Использовались свежеприготовленные растворы при доступе воздуха (медленный барботаж, 0.5 дм3/мин).
Оптическое поглощение растворов измеряли на спектрофотометре Cary-100 UV-Vis (Agilent) в стандартных кварцевых кюветах с длиной оптического пути 1, 5 или 10 мм. Начальный радиационно-химический выход (G) обесцвечивания определяли из зависимости концентрации красителя от поглощенной дозы в области малых доз (до 150 Гр). Образцы для анализа химической потребности в кислороде готовили с использованием термореакторов Lovibond RD 125 и Tagler NT-170 COD. Применялись стандартные реагенты Vario Vial Test LR (3–150 мг/дм3) и MR (20–1500 мг/дм3) фирмы Lovibond Tintometer (Великобритания), а также LEI-5160 (10–160 мг/дм3) и ЛЭИ-5180 (80–800 мг/дм3) производства “ЭКОИНСТРУМЕНТ” (Россия). Образцы анализировали с помощью фотометрической системы Lovibond MD 600. Значения ХПК измеряли сразу после облучения и через 8 ч.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Радиолиз как индивидуальных, так и смешанных растворов, приводит к необратимому уменьшению их окраски с ростом дозы. Рисунок 1 представляет влияние поглощенной дозы на оптическую плотность раствора, содержащего смесь Е104, Е122, Е132 и Е142 (по 0.005 г/дм3), представляющих все четыре класса исследованных красителей. Исходное отличие наблюдаемого спектра (а) от рассчитанного спектра (б), представляющего собой сумму спектров индивидуальных растворов, указывает на наличие в необлученном смешанном растворе (доза 0) взаимодействия и взаимного экранирования молекул/ионов разных красителей по сравнению с индивидуальными растворами. Тем не менее, наблюдается практически независимое обесцвечивание каждого из компонентов смеси в интервале доз до 1 кГр, при этом спектры (а) и (б) демонстрируют сходную пропорциональность изменения оптического поглощения с дозой. Наблюдаемый эффект параллельной деградации важен с точки зрения возможности обесцвечивания смесей красителей в реальных многокомпонентных сточных водах [8].
Рис. 1.
Влияние дозы на спектр оптического поглощения смешанного раствора Е104, Е122, Е132 и Е142 (по 0.005 г/дм3): а – экспериментальные результаты для смеси, б – сумма спектров для отдельных красителей. Значения максимумов поглощения показаны пунктиром.
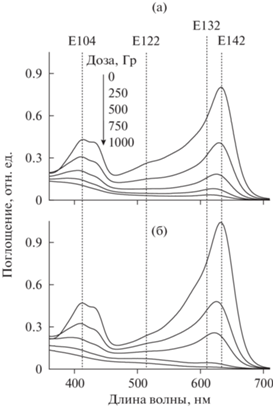
Очевидно, ввиду невысокой концентрации красителей в исследованных растворах, их обесцвечивание происходит по механизму косвенного действия излучения, т.е. в результате реакций красителя с радикалами, генерируемыми из молекул воды [8]. В аэрируемых растворах обесцвечивание осуществляется в основном радикалами ОН, поскольку восстановительные интермедиаты (eaq и Н), быстро захватываются кислородом с образованием менее активных радикалов (–O2 и HO2) [8, 9]. Ключевая роль радикалов ОН в обесцвечивании выявляется экспериментами с добавками трет-бутанола (селективный акцептор ОН радикалов) и хлорной кислоты (селективный акцептор eaq, превращающий eaq в менее реакционноспособные H радикалы). Как показывает рис. 2, при добавлении трет-бутилового спирта оптическое поглощение раствора во время облучения уменьшается незначительно. В свою очередь, присутствие HClO4 обеспечивает наибольшее снижение оптической плотности: совместное действие ОН и Н радикалов приводит к глубокому обесцвечиванию уже при дозе около 0.5 кГр. Однако H радикалы обладают меньшим эффектом обесцвечивания, о чем свидетельствует комбинированное действие кислоты и трет-бутанола. На рис. 2 также видно, что с увеличением дозы максимум поглощения смещается в коротковолновую область, что свидетельствует об уменьшении длины сопряжения в хромофорной системе красителя.
Рис. 2.
Полосы оптического поглощения растворов 0.02 г/дм3 Е124 (а) и Е142 (б) с добавками кислоты и спирта.
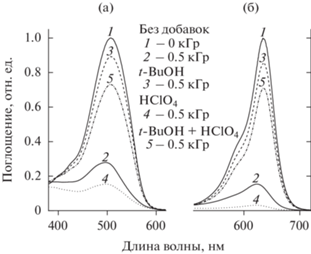
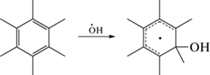
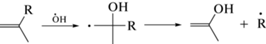
Система сопряжения охватывает большую часть молекулы красителя. Поэтому основной реакцией ОН является присоединение. Большинство реакций присоединения ОН контролируется диффузией, т.е. являются очень быстрыми [8–10]. Сложное строение молекул красителя предоставляет множество мест для атаки ОН, включая ароматические звенья, мостиковые двойные связи и боковые группы. Вместе с тем, есть вероятность гибели ОН в реакциях Н-отщепления с образованием молекул воды [8, 9].
Присоединение ОН по двойной связи повреждает систему внутримолекулярного сопряжения, делая ее короче:
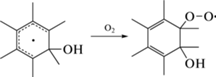
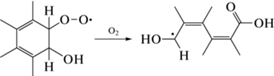
В свою очередь, неспаренный электрон может делокализоваться по остальным сопряженным связям (включая ароматическое звено). В результате в ОН-аддукте возникают конформационные напряжения из-за несоответствия электронных конфигураций ОН-аддукта и исходного звена. В жесткой молекуле красителя релаксация возможна, в частности, за счет разрыва связей в α- или β‑положении относительно радикального центра [9]. В рассматриваемых красителях расщеплению подвержены связи C–N, C–O и C–C. Такие процессы приводят к уменьшению или устранению окраски. В зависимости от состава красителя и условий релаксации, ОН-аддукт может избежать разрыва связи, но сохраняется повреждение системы внутримолекулярного сопряжения. Образовавшийся радикал затем может распадаться в реакции с кислородом или рекомбинировать с другим радикалом [8–10].
Даже низкая доза (1–1.5 кГр) чревата дефицитом растворенного кислорода. Суммарный выход eaq и H в объеме раствора составляет около 0.36 мкмоль/Дж. Соответственно, доза 1 кГр генерирует в сумме около 0.36 ммоль/дм3 eaq и H. Однако растворимость кислорода воздуха даже в чистой воде не превышает 0.28 ммоль/дм3. Следовательно, растворенного кислорода недостаточно для удаления eaq и H. Масштабная очистка сточных вод с помощью ускорителя мощностью 100 кВт при дозе 1 кГр имеет пропускную способность около 85 кг/с [11]. Соответственно, сточные воды находятся в зоне облучения менее 0.1 с. Этого времени недостаточно для восполнения растворенного кислорода из окружающего воздуха, так как скорость растворения не превышает 2–3 мг/дм3 в минуту (0.1 ммоль/(дм3 мин)).
Реакции кислорода с H и eaq уменьшают его участие в окислении органических радикалов. Как следствие, часть радикалов красителя гибнут в реакциях друг с другом. Более того, концентрация красителя (0.02–0.04 мкмоль/дм3) значительно меньше суммарной концентрации радикалов, генерируемых из воды [9]. Следовательно, многие из водных радикалов рекомбинируют друг с другом до контакта с красителем. Кроме того, некоторые радикалы ОН расходуются в реакциях с продуктами разложения красителей, поскольку неокрашенные формы красителей продолжают иметь функциональные группы, способные участвовать в реакциях с радикалами ОН. При низкой концентрации красителя радикал ОН также имеет высокую вероятность гибели в реакциях с H, H2O2, HO2 и –O2 [9]. Поэтому наблюдаемые начальные выходы обесцвечивания красителей составляют примерно 1/3 от выхода радикалов ОН.
Радиолиз может приводить к снижению химического потребления кислорода (ХПК) раствора, в частности, за счет увеличения содержания атомов кислорода в молекуле красителя или за счет распада окисленных радикалов до СО2, Н2О и окислов соответствующих гетероатомов [8, 12–14]. Низкая концентрация красителей в исследованных растворах затрудняет измерение ХПК [7]. В необлученных растворах (20 мг/дм3) ХПК варьируется от 20 (Е102) до 38 (Е133) мг О2 на литр. Гипотетически последовательное добавление двух радикалов ОН и двух молекул кислорода могло бы привести к снижению ХПК на 3 и 2 мг О2 на литр (до 17 и 36 соответственно). Для других красителей ожидаемая разница в ХПК также невелика – от 2 до 4 мг О2 на литр. Для сравнения были проведены опыты с увеличением поглощенной дозы и концентрации красителя в 7.5 раза (до 7.5 кГр и 150 мг/дм3 соответственно). Экспериментальная разница ХПК в исходных и облученных растворах Е104, Е132, Е133, Е142 и Е155 составила от 17 до 34 мг О2 на литр, что примерно в 5–8 раз выше приведенного выше теоретического значения для растворов 20 мг/дм3. Такое изменение означает, что в результате радиолиза молекула красителя приобретает в среднем до 6 атомов кислорода [7]. Однако молекулы исследованных красителей содержат от 16 до 37 атомов углерода, на окисление каждого из которых требуется 2 атома кислорода (до СО2). Кроме того, кислород необходим для окисления атомов Н и некоторых других интермедиатов. Поэтому добавление 6 атомов кислорода незначительно и не вызывает заметного изменения ХПК.
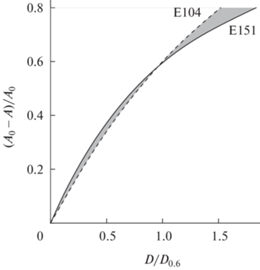
Для большинства протестированных красителей наблюдаемый выход обесцвечивания составляет от 0.05 до 0.08 мкмоль/Дж (табл. 1). Однако в растворах Е133 и Е155 выходы составляют около 0.03, а в растворах Е129, Е132 и Е142 достигают почти 0.1 мкмоль/Дж. Наблюдаемые выходы G обычно коррелируют со значениями дозы полу-обесцвечивания, D1/2. Чем выше G, тем меньше D1/2 (табл. 1). Тем не менее, корреляции между интенсивностью окраски и поглощенной дозой для всех красителей сходны. В диапазоне до 60% обесцвечивания кривые на рис. 3 практически неотличимы друг от друга. Для всех растворов кривые расположены в области между кривыми для Е104 и Е151. Однако при более высоких степенях обесцвечивания различия становятся более заметными, вероятно, из-за конкуренции исходных красителей и их бесцветных производных в реакциях с радикалами воды, из-за недостатка кислорода, из-за поглощения света взвешенными веществами и некоторых других эффектов [8–10].
Таблица 1.
Выход обесцвечивания G и доза половинного обесцвечивания D1/2 (экспериментальный разброс ±7%)
| Краситель | G, мкмоль/Дж | D1/2, Гр |
|---|---|---|
| Е102 | 0.060 | 390 |
| Е122 | 0.081 | 310 |
| Е124 | 0.079 | 280 |
| Е129 | 0.096 | 250 |
| Е151 | 0.077 | 200 |
| Е155 | 0.032 | 610 |
| Е133 | 0.027 | 560 |
| Е142 | 0.108 | 210 |
| Е132 | 0.100 | 260 |
| Е104 | 0.052 | 440 |
Рис. 3.
Корреляция между относительной дозой и степенью обесцвечивания красителей (А0 – оптическое поглощение в необлученном растворе, D0.6 – доза при степени обесцвечивания 0.6).
Меньший выход радиолиза Е155 объясняется тем, что, в отличие от других азокрасителей, система внутримолекулярного сопряжения в нем содержит 3 ароматических звена, связанных двумя азогруппами, что делает его более устойчивым к радиолизу. Для полного обесцвечивания необходимо повреждение сопряжения обеих азогрупп, на что расходуется вдвое больше радиолитических реагентов, чем на деградацию одного хромофорного центра, как, например, в Е122 или Е124. Хромофорная система трифенилметанового красителя Е133 также состоит из нескольких частей, где деградация одной из них не приводит к распаду всей хромофорной системы. Таким образом, E133 и E155 демонстрируют сравнительно более низкую степень обесцвечивания. Красители Е129, Е132 и Е142, напротив, имеют наиболее компактную хромофорную систему, включающую по одному хромофорному центру, повреждение которого нарушает сопряжение между частями молекулы и, тем самым, приводит к обесцвечиванию.
ЗАКЛЮЧЕНИЕ
Пример радиолиза растворов пищевых красителей показывает возможность эффективного необратимого разрушения систем сопряженных связей. В растворах красителей влияние радиолиза на сопряжение связей удобно наблюдать по изменению цветности растворов. При концентрации красителя 20 мг/дм3 на литр, полное обесцвечивание наблюдается при дозе 1–1.5 кГр. Эффект достигается в условиях дефицита растворенного кислорода. Именно такие условия наиболее привлекательны для крупномасштабной электронно-лучевой обработки окрашенных сточных вод с использованием мощных электронных ускорителей [11, 15–17].
Радиолитическое обесцвечивание представителей 4 рассмотренных классов красителей при ограниченном доступе воздуха имеет несомненное сходство, так как состоит в деградации внутримолекулярной системы сопряженных связей, объединяющих хромофорные группы и ароматические звенья. То есть основные превращения заключаются в присоединении радикалов ОН к сопряженным связям и последующего взаимодействия органических радикалов с растворенным кислородом или друг с другом. Механизм и продукты деградации молекул после потери окраски могут быть различными, но повреждение хромофорных систем заключается в однотипном взаимодействии радикалов с двойными связями, ответственными за сопряжение атомов в комбинированную хромофорную систему.
Список литературы
Traven V.F. // Frontier Orbitals and Properties of Organic Molecules (Ellis Horwood Series in Organic Chemistry), Mellor, J. ed. Ellis Horwood Ltd, NY. 1992.
Arora S. // J. Bioremediation Biodegrad. 2014. V. 5. P. e146. https://doi.org/10.4172/2155-6199.1000e146
Tkaczyk A., Mitrowska K., Posyniak A. // Sci. Total Environ. 2020. V. 717. P. 137222. https://doi.org/10.1016/j.scitotenv.2020.137222
Rocha O.P., Cesila C.A., Christovam E.M., Barros S.B., Zanoni M.V., de Oliveira D.P. // Toxicology. 2017. V. 376. P. 113. https://doi.org/10.1016/j.tox.2016.04.002
Collivignarelli M.C., Abbà A., Carnevale Miino M., Damiani S. // J. Environ. Manage. 2019. V. 236. P. 727. https://doi.org/10.1016/j.jenvman.2018.11.094
Kholodkova E.M., Imatdinova D.N., Ponomarev A.V. // High Energy Chem. V. 54(4). P. 296. https://doi.org/10.1134/S0018143920030078
Ponomarev A.V., Kholodkova E.M., Bludenko A.V. // Radiat. Phys. Chem. 2022. V. 199. P. 110357. https://doi.org/10.1016/j.radphyschem.2022.110357
Ponomarev A.V., Ershov B.G. // Environ. Sci. Technol. 2020. V. 54. P. 5331. https://doi.org/10.1021/acs.est.0c00545
Woods R., Pikaev A. // Applied Radiation Chemistry. Radiation Processing. Wiley. NY. 1994.
Wojnárovits L., Takács E. // J. Radioanal. Nucl. Chem. 2017. V. 311. P. 973. https://doi.org/10.1007/s10967-016-4869-3
Ponomarev A.V. // Radiat. Phys. Chem. 2020. V. 172. P. 108812. https://doi.org/10.1016/j.radphyschem.2020.108812
Alkhuraiji T.S., Boukari S.O.B., Alfadhl F.S. // J. Hazard. Mater. 2017. V. 328. P. 29. https://doi.org/10.1016/j.jhazmat.2017.01.004
Kovács K., He S., Míle V., Földes T., Pápai I., Takács E., Wojnárovits L. // Radiat. Phys. Chem. 2016. V. 124. P. 191. https://doi.org/10.1016/j.radphyschem.2015.10.028
Paul J., Naik D.B., Bhardwaj Y.K., Varshney L. // Radiat. Phys. Chem. 2014. V. 100. P. 38. https://doi.org/10.1016/j.radphyschem.2014.03.016
Shen Y., Chu L., Zhuan R., Xiang X., Sun H., Wang J. // J. Environ. Manage. 2019. V. 232. P. 171. https://doi.org/10.1016/j.jenvman.2018.11.050
Wang J., Chu L. // Radiat. Phys. Chem. 2016. V. 125. P. 56. https://doi.org/10.1016/j.radphyschem.2016.03.012
Meeroff D.E., Bloetscher F., Shaha B. // Radiat. Phys. Chem. 2019. V. 168. P. 108541. https://doi.org/10.1016/j.radphyschem.2019.108541
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий